[вернуться к содержанию сайта]
Властелином в физике и в физических законах становится целое число.
А. Зоммерфельд
Для атома было последовательно предложено столько различных, исключающих одна другую моделей, сколько, пожалуй, ни для одного другого физического объекта. После открытия электрона стало ясно, что химические свойства атома, и в первую очередь его способность соединяться с другими атомами (валентность), как-то определяются входящими в его состав электронами. Теряя один или несколько отрицательно заряженных электронов, атом превращается в положительный ион, а приобретая добавочные электроны — в отрицательный ион. Периодический закон, сформулированный в 1868 году Д. И. Менделеевым, гласил, что свойства химических элементов находятся в периодической зависимости от их атомной массы (согласно сделанному позднее уточнению — от атомного номера). В описываемое время было также известно из кинетической теории газов, что размеры атома в обычных условиях — порядка 10–8 см.
Первая модель атома связана с именем Дж. Дж. Томсона. В этой модели атом изображался как совокупность электронов, удерживаемых вместе некоторой центральной силой неизвестной природы. Модель эта продержалась лишь несколько месяцев. В 1898 году произведённые самим Томсоном измерения установили, что масса электрона во много раз меньше массы самого лёгкого атома — атома водорода. Получалось, что атом должен состоять из многих тысяч частиц. Томсон изменил свою модель. Согласно его второй модели (1899 г.), атом состоит из
Z электронов, отрицательные заряды которых компенсируются чем-то таким, что равносильно положительному электрическому заряду Ze.В 1901 году У. Томсон (лорд Кельвин) предложил более определённую модель, в которой положительный заряд
Ze был равномерно распределён по всему объёму атома, ограниченному некоторой сферой. Этот положительный заряд действовал на каждый из Z электронов с силой, пропорциональной расстоянию электрона от центра атома. Если в атоме был только один электрон, он располагался в центре. При наличии двух или большего числа электронов, по Кельвину, они располагаются по сферическим поверхностям и, скорее всего, вращаются вокруг центра. Эта модель в принципе вписывалась в периодическую зависимость свойств элементов от атомной массы. Она была воспринята как развитие модели Дж. Дж. Томсона и вошла в историю физики под названием “атома Томсона”.В то время как электроны считались очень малыми частицами, положительному заряду в атоме Томсона приписывались относительно большие размеры, совпадающие с размерами атома. По-видимому, в этом сказалась обыденная привычка связывать малые массы с малыми размерами и большие массы — с большими. Собственно, такая закономерность не только не обязательна для микромира, но отнюдь не соблюдается и в обычном нашем окружении. Плотность железа и меди примерно на порядок больше, чем у дерева или воды, а средняя плотность воздушного шара, как и воздуха, на много порядков меньше. Тем не менее остаётся фактом, что указанной привычке была заплачена дань при построении модели атома.
В 1903 году японский физик Хантаро Нагаока (1865—1950 гг.) предложил модель атома, аналогичную Солнечной системе. В его модели весь положительный заряд и почти вся масса атома сосредоточены в центре, вокруг которого обращаются электроны, подобно планетам вокруг Солнца. При этом все электроны движутся по одной и той же круговой орбите на равных интервалах один от другого, что напоминает кольцо Сатурна. От внимания Нагаоки не ускользнул весьма важный вопрос. Он писал: “Возражение против такой системы электронов заключается в том, что эта система в конце концов должна погибнуть вследствие потерь энергии на излучение”. В самом деле, при обращении по орбите электрон движется с центростремительным ускорением и согласно классической электродинамике должен непрерывно излучать электромагнитные волны. При этом электрон теряет энергию и всё
более сближается с ядром, пока не упадёт на него. Проблема непрерывного излучения энергии, впервые сформулированная Нагаокой, относится не только к выдвинутой им модели, но и к любой модели атома, в которой электроны движутся с теми или иными ускорениями.Модель атома Нагаоки не имела большого успеха. По-видимому, сказалось необычное и в то время ничем не обоснованное предположение об атомном ядре, а также неразрешённая проблема непрерывного излучения энергии электронами.
Однако спустя восемь лет было доказано, что атом действительно имеет ядро, в котором сосредоточены весь положительный заряд
Ze и почти вся масса атома. Это доказал на основе экспериментов Эрнест Резерфорд (1871—1937 гг.). Работавшие под его руководством Марсден и Гейгер в 1909 году исследовали прохождение пучка α-частпц, испускаемых радием, через тонкие пластинки золота и других материалов. Они обнаружили, что некоторая, хотя и очень незначительная, доля α-частиц отклоняется на большие углы, вплоть до 180°. Как впоследствии отмечал Резерфорд, “это было почти столь же невероятно, как если бы вы выстрелили 15-дюймовым снарядом в листок папиросной бумаги, а он вернулся бы назад и угодил бы в вас”.В 1911 году Резерфорд опубликовал работу “Рассеяние α- и β-частиц веществом и строение атома”, в которой показал, что отклонение α-частиц на большие углы возможно лишь при наличии в. атоме весьма сильного электрического поля, т. е. при существовании в нём электрически заряженного ядра с размерами не более 10–12 см. В статье была также выведена формула, дающая вероятности рассеяния падающих частиц на различные углы. При выводе этой формулы Резерфорд считал отрицательный заряд электронов — Ze равномерно распределённым по объёму атома, в пределах сферы радиусом 10–8 см с ядром в центре. Оказалось, что такой распределённый заряд практически не влияет на рассеиваемые частицы.
Итак, Резерфорд экспериментально обосновал ядерную модель атома, т. е. наличие в нём массивного положительно заряженного ядра. Однако он воздержался в своей статье 1911 года от предположений о планетарном или каком-либо ином характере движения электронов в атоме. Он лишь кратко упомянул о сатурнианском атоме Нагаоки.
В ядерной модели многое быстро встало на свои места. Именно заряд атомного ядра
Ze, a не атомная масса определяет число электронов в атоме, свойства химического элемента и его порядковый номер в системе Менделеева. Атомный номер Z=1 имеет водород, его ядра — протоны; номер Z=2 принадлежит гелию, ядра гелия — это α-частицы, и т. д.Планетарная и вместе с тем первая квантовая модель атома была построена в 1913 году Нильсом Бором (1885—1962 гг.). Н. Бор объединил в одно неразрывное целое известные к тому времени закономерности и концепции, на первый взгляд имевшие очень мало общего.
Отправными положениями при создании боровской модели были:
1) ядерная модель атома (Резерфорд, 1911 г.);
2) планетарный характер движения электронов (Нагаока, 1903 г.);
3) длительное устойчивое существование атомов;
4) концепция дискретных стационарных состояний системы с определёнными уровнями энергии Еп
и скачкообразных переходов между ними, сопровождающихся излучением или поглощением световых квантов с частотой ν = (En1—En2)/h (Планк, 1900 г.; Эйнштейн, 1905—1906 гг.);5) квантование величины действия (Планк и
Зоммерфельд, 1911 г.);6) комбинационный принцип (Ритц, 1908 г.), согласно которому частота любой спектральной линии излучения или поглощения есть разность каких-либо двух величин (термов) вида cR/(n+δ)2, т. е. ν/c=R[(n2+δ)-2— (n1+δ)-2]. Здесь n1 и n2 — целые числа; R — так называемая постоянная Ридберга; δ — постоянная, характерная для данной серии спектральных линий (для водорода δ=0).
Н. Бор постулировал, что электроны в атоме могут обращаться вокруг ядра не по любым, а
только по некоторым дискретно расположенным орбитам. Эти орбиты стационарны, так как на них электроны не излучают энергии, вопреки законам электродинамики. Радиусы круговых стационарных орбит а определяются из условия, чтобы момент импульса электрона meva был целым кратным величины h/2π. Это условие равносильно условию квантования действия mev·2πa = nh.Далее Бор принял два допущения: 1) динамическое равновесие системы в стационарных состояниях можно рассматривать с помощью обычной механики, тогда как переход системы из одного стационарного состояния в другое нельзя трактовать на этой основе; 2) указанный переход сопровождается испусканием или поглощением монохроматического излучения, для которого соотношение между частотой и количеством выделенной (или поглощённой) энергии именно такое, которое даёт теория Планка.
Пусть заряд ядра равен
Ze и в атоме только один валентный электрон (такой атом называют водородоподобным). При круговой орбите, согласно первому допущению, действующая на электрон центробежная сила уравновешивается его притяжением к ядру по закону Кулона: mev2/a = Ze/a2.Отсюда и из приведённого выше условия квантования нетрудно найти радиусы стационарных орбит:
a = n2h2/4π2meZe2.При этом полная энергия электрона, то есть сумма его кинетической и потенциальной энергии, составит
En= mev2/2– Ze2/a= Ze2/2a – Ze2/a=2π2meZ2e4/n2h2.
Входящее сюда целое число п называют главным квантовым числом.
При переходе со стационарной орбиты с n=n1 на стационарную орбиту с n=n2, согласно второму допущению, испускается или поглощается излучение с энергией En1—Еn
2 и частотой (делённой на с):ν
/c= (En1—Еn2)/hc=2π2meZ2e4/h3c·(1/n22–1/n12).Величина, стоящая в правой части перед скобками есть постоянная Ридберга. Таким образом, Бор вычислил её теоретически. Вычисленное значение хорошо совпало с экспериментальным, которое согласно современным измерениям 109677,58 см–1 (для водорода). Бор вычислил также радиус первой стационарной орбиты в атоме водорода (Z=1, n=l), т. е. “радиус атома”:
a1= h2/4π2mee2=0,529·10–8 см.
Кроме того, Бор показал, что с ростом заряда ядра Ze электроны образуют одну за другой вторую и последующие электронные оболочки. Тем самым он качественно объяснил периодическую зависимость свойств химических элементов от заряда ядра, т. е. от порядкового номера в периодической системе Д. И. Менделеева.
В дальнейшем теория Бора была усовершенствована Зоммерфельдом, Эпштейном и Шварцшильдом. Были введены эллиптические электронные орбиты и три независимых квантовых числа: радиальное nr, экваториальное nθ и широтное nψ, – соответствующих трём координатам в сферической системе координат. При этом суммы
nφ= nθ + nψ, n=nr + nθ + nψ= nr + nφ
представляют собой азимутальное и главное квантовые числа. Целые числа п,
nφ, nψ определяют большую и малую полуоси эллиптической орбиты и угол наклона её плоскости:a=n2a1/Z; b=nnφa1/Z; ψ=аrссоs (± nψ/nφ).
Энергия стационарного состояния
En по-прежнему определяется главным квантовым числом n и выражается приведённой выше формулой.Зоммерфельд, исходя из планетарной модели Бора, построил релятивистскую теорию водородоподобных атомов. Согласно специальной теории относительности масса электрона зависит от его скорости. Оказалось, что это приводит к постепенному повороту большой оси эллиптической орбиты. В результате электрон описывает розеточную траекторию, подобную траектории планеты Меркурий (см. рис. 3). Однако сходство здесь только внешнее, так как движение Меркурия описывается законами не специальной, а общей теории относительности. Зоммерфельд получил релятивистское выражение для энергии стационарных состояний:
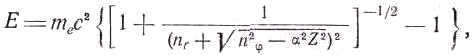
где α
=2πe2/hc= 1/137 — постоянная тонкой структуры. Полученную формулу, хорошо согласующуюся с опытом, называют формулой тонкой структуры. Она показывает, что энергия стационарного состояния зависит не от суммы n= nr+nφ, а от квантовых чисел nr и nφ по отдельности. При релятивистском рассмотрении выясняется, что спектральные линии расщеплены, т. е. на их месте находятся тесные группы линий.После открытия спина электрона С. Гаудсмитом и Д. Уленбеком (1925 г.) было введено четвёртое квантовое число — спиновое число, принимающее только два значения ±1. В. Паули в 1925 году в результате анализа большого экспериментального материала сформулировал принцип, согласно которому в каждом стационарном состоянии, характеризуемом определёнными значениями четырёх квантовых чисел, может находиться не более одного электрона.
Однако, несмотря на значительные первоначальные успехи, в конечном счёте модель атома Бора не оправдала возлагавшихся на неё надежд. В 1923 году М. Борн и В. Гейзенберг установили, что на её основе нельзя рассчитать уже атом с двумя электронами — атом гелия. Тем более она не позволяла объяснить строение и рассчитать спектры многоэлектронных атомов.
Надо ли говорить, что отказ от классической электродинамики не мог в то время вызвать восторгов и был встречен многими физиками со скептицизмом и критикой. К тому же объединение классических и квантовых составных элементов в одной теории выглядело неестественным. Как шутливо заметил У. Брэгг, приходилось по понедельникам, средам и пятницам руководствоваться классическими законами, а по
вторникам, четвергам и субботам — квантовыми.Заслуживало внимания и такое физически наглядное возражение против планетарной модели. Представим себе, что планетная система нашего Солнца столкнулась с другой планетной системой. Даже если бы после столкновения обе системы и уцелели, они наверняка не сохранились бы в прежнем виде. Между тем, атомы газа многократно сталкиваются друг с другом, как упругие тела, не претерпевая никаких изменений. Это свидетельствует о высокой степени устойчивости атома, недостижимой при его планетарном строении.
На примере планетарной модели атома до настоящего времени показывают неприменимость классической механики и электродинамики к атомным явлениям. Правда, при этом не выполняют всех требований формальной логики. Из несовместимости планетарной модели с классической физикой следует лишь, что по крайней мере одна из них непригодна. Но ведь непригодной оказалась планетарная модель.
Чтобы показать неприменимость классической физики, следовало бы доказать, что с ней несовместима вообще никакая модель атома
.Между тем, как это ни удивительно, построить совместимую с классической механикой и электродинамикой модель атома вполне возможно.
Действительно, представим себе сначала заряд, равномерно распределённый по объёму тонкого кольца (тора) и движущийся вдоль него с постоянной скоростью. Такое заряженное вращающееся кольцо создаёт электрическое и магнитное поля, постоянные во времени, и не излучает электромагнитной энергии. Нe излучает энергии и любая совокупность таких элементарных колец, имеющих общую ось вращения. Таким образом, получаем “ротационную” модель атома, в которой положительно заряженное ядро окружено отрицательным зарядом электронов, распределённым с вращательной симметрией по объёму атома и вращающимся вокруг оси, проходящей через ядро. Распределения заряда и тока постоянны во времени. Электрическое и магнитное поля, создаваемые этим распределённым зарядом и током электронов, также обладают вращательной симметрией и постоянны во времени. Векторы электрического и магнитною полей Е, Н лежат в плоскостях, проходящих через ось вращения, и излучение энергии отсутствует.В ротационной модели электроны имеют те же размеры, что и атом, т.е. размеры порядка 10–8 см. Ясно, что ротационное распределение заряда электронов для своего удержания требует сил неэлектродинамической природы. Но это не есть какое-либо новое требование. Неэлектродинамические силы необходимы при любых предположениях об электроне, не исключая и концепции точечного электрона. Далее, естественно предположить, что необходимое равновесие между всеми действующими силами достигается не при любых, а лишь при некоторых ротационных распределениях заряда тока. Следовательно, ротационная модель вполне вписывается в концепцию дискретных стационарных состояний атома. Наконец, при наличии двух или большего числа ядер можно допустить существование равновесных распределений заряда и тока, не обладающих вращательной симметрией, но тем не менее постоянных во времени и не излучающих электромагнитной энергии. Такие распределения могут служить моделями молекул и кристаллов.
С позиций современной физики ротационная модель атома вряд ли заслуживает серьёзного внимания, и её скорее надо рассматривать как исторический курьёз. Но эта модель вполне могла быть предложена, скажем, в 1911–1913 гг. Она имела бы успех в тот период, когда не было известно многое из того, что мы знаем теперь, а стремление сохранить классические представления ещё были достаточно сильным.
Итак, от планетарной модели атома и построенной на её основе теории пришлось отказаться. Их сменила возникшая в 1925–1926 гг. квантовая механика. Однако атом Бора явился важным этапом в развитии квантовых идей и отходе от классической физики.
Дата установки: 14.10.2007
[вернуться к содержанию сайта]