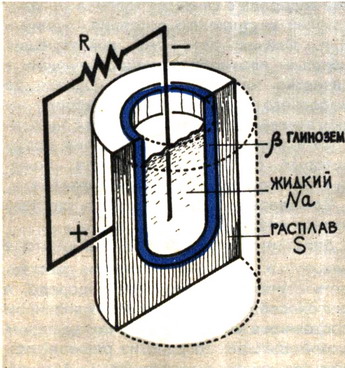
Принципиальная схема электрической батареи с твёрдым электролитом
[вернуться к содержанию сайта]
“Кристаллы встречаются нам повсюду. Мы ходим по кристаллам, строим из кристаллов, обрабатываем кристаллы на заводах, выращиваем кристаллы в лабораториях и в заводских установках, создаём приборы и изделия из кристаллов, широко применяем кристаллы в технике и науке, едим кристаллы, лечимся кристаллами, находим кристаллы в живых организмах, проникаем в тайны строения кристаллов, выходим на просторы космических дорог с помощью приборов из кристаллов и растим кристаллы в космических лабораториях” – так писала известный советский кристаллограф Марианна Шаскольская в книге “Кристаллы”.
Слово кристалл неизбежно ассоциируется у нас с чем-то твёрдым, правильной формы, с многими гранями. Это может быть кристаллик льда или поваренной соли, кварца или алмаза. Но для учёных, изучающих проблемы физики твёрдого тела, такие классические кристаллы уже не представляют особого интереса. Теперь ставятся вопросы посложнее. А не рассмотреть ли нам кристаллы одномерные или двумерные? Что вы скажете по поводу существования четырёхмерных кристаллов? Как объяснить, что вещество, находящееся при температуре, близкой к абсолютному нулю, остаётся жидкообразным, но зато проявляет некоторые характерные свойства кристаллов? Словом, на первый план выдвигаются сейчас так называемые неклассические кристаллы. Читателям “Техники и Науки” мы уже дважды рассказывали о жидких кристаллах (1979, № 1 и 1982, № 4) – типичных представителях “племени” кристаллов неклассических.
В конце 1982 г. в Армении состоялось представительное Всесоюзное совещание-семинар по неклассическим кристаллам. О некоторых свойствах и интересных аспектах возможного практического использования таких кристаллов рассказывает д-р физ.-мат. наук В. БЕЛЯКОВ.
Исследования неклассических кристаллов находятся уже на такой стадии, когда намечаются вполне реальные пути выхода на практику. В частности, повышение надёжности и экономичности разнообразных изделий, существенная их миниатюризация. Более того, можно уверенно прогнозировать создание новых технологических процессов, появление материалов с такими свойствами, до которых ещё не додумались даже фантасты.
Поскольку обо всём из-за ограниченного объёма статьи все равно рассказать нельзя, остановимся только на некоторых направлениях возможного использования этих необычных веществ.
Атомы одного вещества могут внедряться в кристаллическую решётку другого, или замещая атомы последнего в узлах решётки, или располагаясь в её междоузлиях. Охотно внедряются в кристаллические решётки многих переходных металлов и атомы водорода, образуя своеобразную систему металл-водород. Но в отличие от большинства веществ водород в этой системе ведёт себя по нашим представлениям “не по правилам”: то его атомы образуют свой собственный кристалл внутри кристаллов металла, куда они внедрились, то ведут себя там как жидкость, а то и обретают свойства газа. Более того, в зависимости от давления и температуры образовавшиеся водородные кристаллы могут претерпевать фазовые переходы, то есть переходить из одной кристаллической модификации в другую. Такое поведение водорода уже само по себе чрезвычайно интересно и служит предметом тщательного изучения. Но ещё более впечатляет поведение атомов водорода при охлаждении системы металл-водород.
По классическим представлениям понижение температуры влечет за собой ослабление теплового движения атомов, уменьшение их диффузии. Более того, при абсолютном нуле тепловое движение и диффузия атомов должны полностью прекратиться.
Однако исследователи обнаружили, что водород не хочет подчиняться этим закономерностям. При понижении температуры движение его атомов не очень-то замедляется. А при температуре, близкой к абсолютному нулю (1 К и ниже), они не только не “успокаиваются”, но начинают диффундировать даже интенсивнее, чем прежде. Пришлось признать, что атомы водорода перестают подчиняться законам классической механики.
Уже четверть века ломают копья при обсуждении этой проблемы. Один из предлагаемых вариантов заключается в том, чтобы воздействием сверхвысокого давления получить металлический водород, а затем использовать его для получения высокотемпературной сверхпроводимости.
И вот тут-то пересеклись пути такого сверхпроводящего водорода и выявленных аномалий поведения водорода в металлах.
Создать давление порядка мегабар уровень современной науки и техники позволяет. Значит, есть надежда газообразный водород уплотнить настолько, чтобы создать его металлическую фазу. Но задача заключается в том, чтобы получить не просто фазу с металлической проводимостью, а фазу метастабильную, то есть сохраняющую проводимость после снятия высокого давления. Пока же ни металлическую фазу водорода, ни, тем более, метастабильную его фазу получить никому не удалось.
А вот водород, внедрённый в кристаллическую решётку металла,– это то, что нужно. Путь здесь такой. Сначала получим в решётке металла высокую концентрацию атомов водорода. Сделать это можно так. Кусок металла нагреваем до высокой температуры в атмосфере водорода и выдерживаем его там достаточно долго. В результате диффузии в решётку металла проникает множество атомов водорода, возникает большая их концентрация, которая сохранится и после охлаждения металла. Расстояние между внедрёнными атомами водорода, расположившимися в узлах или междоузлиях кристаллической решётки металла, намного меньше, чем в газообразной фазе. А это ведь по своему эффекту равносильно приложению к газу внешнего высокого давления.
Так получаем аналог металлического водорода.
Эксперименты показали, что в решётке металла можно получить и метастабильное состояние водорода.
Потому-то учёные рассматривают сейчас этот путь как весьма перспективный для получения не просто сверхпроводимости, но и сверхпроводимости высокотемпературной.
Не менее важной, чем сверхпроводимость, учёные считают проблему водородной энергетики, то есть использование водорода в качестве топлива для двигателей внутреннего сгорания, турбин и т. п. Сейчас есть уже действующие образцы автомобилей, использующих в качестве топлива водород. Однако до массового применения “водородных” двигателей ещё далеко. На пути водородного топлива немало препятствий, среди которых самое существенное, пожалуй,– его хранение и транспортировка.
Вот здесь-то может выручить система металл-водород.
Действительно, если признать, что в некоторых металлах возможно растворять огромное количество водорода, а его способность находиться в связанном состоянии в металле зависит от давления и температуры, то одно из решений может заключаться в следующем. Металл, например цирконий, при высокой температуре и давлении насыщают водородом, а затем температуру и давление понижают до нормальных условий. При этом водород оказывается как бы запертым в решётке металла, причём с высочайшей степенью плотности. Вот вам и резервуар для хранения водорода! А внешнего давления при этом для поддержания такой высокой плотности не требуется. Извлечь же водород из металла можно тоже очень просто. Для этого достаточно чуть-чуть повысить температуру, и его атомы начнут покидать решётку металла. Такое изящное решение вполне осуществимо.
Система металл-водород даёт надежду на осуществление весьма оригинального способа транспортировки водорода-топлива к двигателю без использования труб. Если под влиянием внешнего воздействия удастся вызвать перемещение атомов водорода в решётке металла в определённом направлении, то это будет, так сказать, способ передачи водорода на расстояние по проводам.
О том, что такой способ транспортировки вполне реален, сейчас уже сомнений нет. А вот как это можно осуществить, вы узнаете немного позже.
Существует необычный, мало кому известный класс веществ, свойства которых уникальны. Это – суперионные проводники или твёрдые электролиты.
Вспомним, электрическая проводимость твёрдых тел определяется их электронной структурой. А расплавы, электролиты обладают проводимостью ионной. Отсюда, казалось бы, вытекает простой критерий: если наблюдается электронная проводимость – значит, мы имеем дело с твёрдым веществом, если ионная – с жидкостью или расплавом. Но, оказывается, есть вещества, не укладывающиеся в рамки такого критерия. Эти вещества тверды, как все кристаллы, упруги, механически прочны. И в то же время при температуре, далёкой от температуры плавления, они наделены ионной проводимостью, причём эта проводимость оказывается близкой к проводимости расплава, а иногда даже превосходит её. Вот такие вещества и называют суперионными проводниками.

Принципиальная схема электрической батареи с твёрдым электролитом
В качестве примера типичного суперионного проводника можно привести соединение Ag4RbI5. Оно обладает ионной проводимостью даже при комнатной температуре. Причём эта проводимость в 1018 выше, чем ионная проводимость поваренной соли при той же температуре. Есть чему удивляться! Ведь проводимость здесь создают не лёгкие электроны, как в металлах, а в сотни тысяч раз более тяжёлые ионы серебра.
Откуда же в твёрдом веществе берётся такое огромное количество свободных ионов? Чтобы разобраться в физической сущности ионной проводимости, нужно вспомнить, что ионный кристалл может считаться идеальным в строгом смысле этого слова лишь при температуре абсолютного нуля. При повышении температуры часть ионов оказывается обязательно выброшенной из узлов кристаллической решётки за счёт тепловых возбуждений. При этом они попадают в пространство между узлами решетки, или, как говорят, в междоузлия. Оставшийся не занятый ионом узел кристаллической решётки принято называть вакансией. Таким образом, в кристалле при температуре, отличной от абсолютного нуля, всегда есть ионы в междоузлиях и вакансии. Под действием приложенного к кристаллу электрического напряжения ионы в междоузлиях и вакансии могут мигрировать из одного положения в другое, создавая ток в ионном кристалле. Величина тока при этом прямо пропорциональна числу вакансий или ионов в междоузлиях.
В большинстве образцов ионных кристаллов число вакансий и ионов в междоузлиях мало относительно общего числа узлов в решётке, сравнительно слабо зависит от температуры и плавно меняется при её изменении. Поэтому здесь наблюдается лишь очень низкая, по сравнению даже с полупроводниками, ионная проводимость. В соединениях, относящихся к суперионным, ситуация иная. При повышении температуры и достижении ею определённой величины, число вакансий и ионов в междоузлиях лавинообразно возрастает, оказываясь вполне сравнимым с общим числом узлов решётки кристалла. В этом и заключается причина того, что проводимость твёрдых электролитов оказывается настолько высокой, что может превосходить проводимость расплавов и полупроводников.
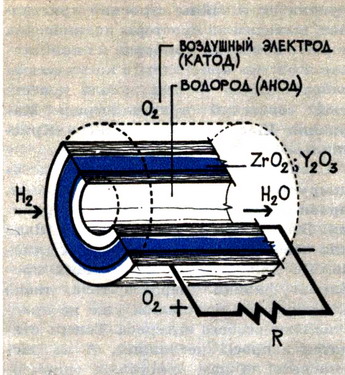
Принципиальная схема топливного элемента.
Здесь сразу же следует отметить: лавинообразно возрастает число вакансий и ионов в междоузлиях только у одного сорта ионов. Другие же ионы данного вещества продолжают оставаться на своих местах. Происходит как бы плавление решётки, образованной только ионами одного сорта, и внутри решётки остальных ионов возникает жидкость ионов расплавившейся подрешётки. В решётке соединения Ag4RbI5, образованной ионами Rb и I, существует жидкость ионов серебра Ag+. Таким образом, наличие аномально высокой ионной проводимости в суперионных проводниках связано с плавлением решётки ионов определённого типа при сохранении решётки, образованной другими ионами в кристалле.
Пока речь шла лишь о неорганических кристаллических соединениях. Однако свойства суперионных проводников могут быть у некоторых стеклообразных и даже органических полимерных веществ.
Учёным удалось получить твёрдые кристаллические соединения и с высокой протонной проводимостью, то есть соединения, в которых перенос заряда выполняют ионы водорода. И теперь мы можем вернуться к проблеме транспорта водорода.
Вот, например, есть соединения KHF2 или KH2PO4. В них носителями заряда служат ионы водорода Н+. Значит, электрический ток в этих веществах представляет собой ток атомов водорода, точнее, ионов водорода. Вот и появилась возможность создать проводники из таких материалов и транспортировать по ним водород. Достаточно создать обычную разность потенциалов на концах проводника, как по нему потечёт поток атомов водорода.
Читатель, наверное, давно уже ждёт примеров практического использования сделанных учёными открытий. Что ж, вот примеры.
Одно из наиболее известных и эффективных применений суперионных проводников – использование их в качестве электролитов в электрических батареях.
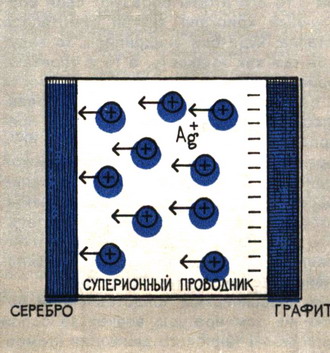
Электрохимическая ячейка с графитовым и серебряным электродами.
Вернёмся к уже известному нам соединению Ag4RbI5. Батарея из него прочна, функционирует в диапазоне температур от –55 до +75° С, способна длительное время, годами, давать устойчивый ток. Такие батареи созданы и успешно прошли испытания. В процессе работы в них происходит преобразование химической энергии взаимодействия атомов серебра и йода в электрическую.
В другой конструкции батареи в качестве электролита используют суперионный проводник β-глинозёма, а в качестве электродов – жидкий натрий и расплав серы. Это – натрий-серная батарея. Её особенность – рекордные параметры по мощности (на каждый килограмм массы мощность 200–300 Вт, а электроёмкость – до 300 Вт·ч). Здесь, в твёрдом электролите – (5-глинозёме – носителями тока служат ионы натрия Na+. Огромное достоинство натрий-серной батареи заключается ещё и в том, что она может выполнять функции аккумулятора. Если через неё, разряженную, пропустить электрический ток в обратном направлении, она становится пригодной к повторному использованию в качестве батареи. Число циклов зарядки может достигать нескольких сотен.
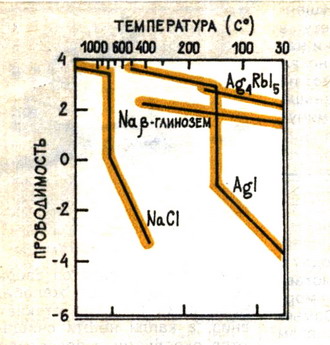
Электрическая проводимость некоторых ионных кристаллов. Скачок проводимости, например, у поваренной соли вызван её плавлением.
Есть возможность использовать суперионные проводники и в топливных элементах, где, как и в батареях, химическая энергия превращается в электрическую.
На одном из рисунков показана схема высокотемпературного топливного элемента, в котором функцию электролита выполняет твёрдый раствор, содержащий цирконий и иттрий – ZrO2-Y2O3.
В этой ячейке прямая трансформация химической энергии в электрическую в принципе гораздо более эффективна, чем получение электроэнергии обычным путём с помощью генераторов в сочетании с турбинами.
Суперионные проводники оказалось возможным использовать для создания высокотемпературных нагревательных элементов, способных работать в атмосфере, содержащей кислород, то есть в условиях, исключающих продолжительную работу обычных высокотемпературных устройств, например нити лампочки накаливания. Здесь полезными оказались суперионные проводники с ионной проводимостью, осуществляемой ионами кислорода. Так, нагревательный элемент на основе ZrO2-CaO может при работе на воздухе давать температуру до 2200°С. Более того, чем выше содержание кислорода в окружающей среде, тем лучше элемент работает.
Зависимость некоторых свойств твёрдого электролита от состава среды (например, от концентрации кислорода в приведённом выше примере) может быть использована для создания датчиков содержания газов в окружающей среде. Уже созданы основанные на этом принципе анализаторы содержания газообразного кислорода, серы, фтора, водорода, углекислого газа, метана. Здесь важно то, что о содержании газов судят по изменению электрических характеристик цепи, содержащей твёрдый электролит, а это, как известно, наиболее удобная для преобразования и обработки получаемой информации форма. В частности, очень перспективно использовать такие датчики для поддержания оптимального режима сжигания топлива в автомобильных двигателях, тем самым сводя к минимуму расход топлива и содержание вредных примесей в выхлопных газах.
Не имея возможности рассказать о многих других направлениях использования суперионных проводников, в частности в системах обработки информации, в медицине, завершим наше обозрение оригинальным примером. Речь пойдёт о возможности прецизионного регулирования положения центра тяжести тела, так сказать, на атомном уровне. Идея состоит в том, чтобы использовать перенос массы, связанный с ионным током. Действительно, поскольку в суперионных проводниках ток – это движение ионов, то с его помощью можно регулировать смещение центра тяжести проводника. При одном направлении тока центр тяжести будет перемещаться в одну сторону, а при другом – в другую. Зная массу ионов – носителей тока, легко рассчитать, какое количество электричества следует пропустить через систему, чтобы сместить положение её центра тяжести на заданную величину.
Таковы некоторые возможности неклассических кристаллов. И кто знает, какие ещё пути практического их применения найдут учёные, воплотят в конкретные устройства инженеры. Вот где неиссякаемый источник идей и творческого поиска.
Дата установки: 8.03.2016
[вернуться к содержанию сайта]