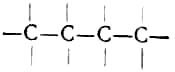
[
вернуться к содержанию сайта]В прекрасных стихах поэмы Лукреция дошло до нас бессмертное учение Левкиппа (V в. до н. э.), Демокрита (470—357 до н. э.) и Эпикура (341—270 до н. э.) о первоначалах всех вещей и явлений — атомах. Отрицая божественное происхождение мира, эти философы пытались объяснить все явления природы движением различных по форме и массе мельчайших невидимых частиц. Многочисленные подтверждения своим взглядам они находили в наблюдениях за окружающим миром:
За основанье тут мы берём положенье такое:
Из ничего не творится ничто по божественной воле.
И оттого только страх всех смертных объемлет, что много
Видят явлений они на земле и на небе нередко,
Коих причины никак усмотреть и понять не умеют,
Вот посмотри: всякий раз, когда солнечный свет проникает
В наши жилища и мрак прорезает своими лучами,
Множество маленьких тел в пустоте ты увидишь, мелькая,
Мечутся взад и вперёд в лучистом сиянии света;
Будто бы в вечной борьбе они бьются в сраженьях и битвах...
Знай же: идёт от начал всеобщее это блужданье.
Первоначала вещей сначала движутся сами,
Следом за ними тела из малейшего их сочетанья,
Близкие, как бы сказать, по силам к началам первичным,
Скрытно от них получая толчки, начинают стремиться
Сами к движенью, затем понуждая тела покрупнее.
Так, исходя от начал, движение мало-помалу
Наших касается чувств и становится видимым также
Нам и в пылинках оно, что движутся в солнечном свете,
Хоть незаметны толчки, от которых оно происходит 1.
С момента возникновения атомистическое учение жестоко преследовалось служителями церкви. Последователей Демокрита подвергали гонениям, а их произведения сжигали. В эпоху средневековья атомистические представления были полностью отброшены и в течение более тысячи лет в науке господствовало учение Аристотеля (384—322 до н. э.) о происхождении всего существующего из четырёх начал: воды, земли, воздуха и огня.
Взгляды древнегреческих философов вновь стали распространяться среди западноевропейских учёных лишь в эпоху Возрождения. Атомистические представления развивали такие выдающиеся мыслители, как Николай Кузанский (1401—1464), Джордано Бруно (1548—1600), Ренэ Декарт (1596—1650).
Одна из первых попыток объяснения химических явлений на основе атомистических представлений принадлежит профессору медицины из г. Виттенберга Даниэлю Зеннерту (1572—1637), который утверждал, что при растворении в кислотах атомы металлов сохраняют свою индивидуальность и потому всегда могут быть извлечены из образовавшихся соединений. В середине XVII в. французский философ и физик Пьер Гассенди (J592—1655) заново пересказал учение Эпикура, дополнив его новым понятием “молекула” для обозначения различного сочетания атомов друг с другом.
Католическая церковь упорно противилась возрождению атомистических представлений. Об этом свидетельствует хотя бы тот факт, что 4 сентября 1624 г. парижским парламентом был издан специальный указ, запрещающий под страхом смертной казни распространение и обсуждение произведений древних авторов. Однако все попытки “отцов церкви” задержать развитие науки были напрасны. Во второй половине XVII в. произошло множество открытий в областях физики и химии. Огромную роль в этом сыграли работы выдающихся английских учёных Роберта Бойля (1627—1691) и Исаака Ньютона (1643—1727).
После более чем десяти лет тщательного экспериментирования в своей хорошо оснащённой лаборатории Р. Бойль написал знаменитую книгу “Химик-скептик”, в которой доказал нереальность “начал” Аристотеля и ввёл представление о химических элементах как о веществах, не поддающихся дальнейшему разложению. Определив задачей химии изучение элементов и их соединений, Р. Бойль поставил её на научную основу. Ф. Энгельс отметил эту заслугу исследователя кратко и определённо: “Бойль делает из химии науку”2.
И. Ньютон тоже занимался химией почти всю свою жизнь. Он изучал сплавы, много работал над усовершенствованием методов пробирного анализа. Результаты своих многолетних экспериментальных исследований ученый изложил в большом сочинении, которое очень высоко ценил и ставил его в один ряд со своими главными трудами по механике и оптике. К сожалению, рукопись этого произведения погибла во время пожара и её содержание до нас не дошло.
Задача учёных XVII в. заключалась главным образом в том, чтобы дать наглядное представление о химических явлениях с помощью образов, заимствованных из механики. Атомы наделялись поэтому шероховатой или гладкой поверхностью, колечками, клинышками, крючками, иголками и прочим фантастическим оснащением. Это обстоятельство не могло не вызывать насмешек со стороны многих естествоиспытателей, которые стали называть атомистические представления “философией остриёв и крючочков”.
От наивных представлений о сложной форме атомов одним из первых отказался замечательный русский учёный Михаил Васильевич Ломоносов (1711—1765). Его научная и практическая деятельность отличалась удивительной широтой и разносторонностью. “Только теперь, спустя два века, можно с достаточной полнотой охватить и должным образом оценить всё сделанное этим удивительным богатырём науки. Достигнутое им одним в областях физики, химии, астрономии, приборостроения, геологии, географии, языкознания, истории достойно было бы деятельности целой Академии”3. Но более других наук М. В. Ломоносов любил химию. Он утверждал, что все происходящие в природе химические и физические явления обусловлены внутренним движением частиц вещества. Наделив атомы массой, шарообразной формой и способностью к движению, учёный объяснил процессы растворения, испарения и теплопередачи, а также высказал ряд важных положений, которые спустя 130 лет легли в основу кинетической теории газов. Полагая, что химические процессы тесно связаны с тепловыми, электрическими, световыми и капиллярными явлениями, М. В. Ломоносов считал знание физики залогом успешной деятельности в области химии. “Химик без знания физики, — писал он, — подобен человеку, который всего должен искать ощупом. И сии две науки так соединены между собой, что одна без другой в совершенстве быть не могут”4.
М. В. Ломоносова по праву можно считать основоположником количественного метода исследования. Он одним из первых стал применять весы для изучения закономерностей протекания химических реакций. Повторив опыты Р. Бойля по накаливанию металлов в запаянных стеклянных сосудах, М. В. Ломоносов открыл закон сохранения массы веществ при химических реакциях. В 1909 г. правильность этого закона была доказана с точностью до 10-6 %.
Количественный метод исследования быстро завоевал всеобщее признание; к концу XVII в. он являлся уже основой химического эксперимента. Учёные стали систематически прибегать к измерению объёмов и взвешиванию. Большая заслуга в этом принадлежит также выдающемуся французскому химику Антуану Лорану Лавуазье (1743—1794), который не только развил и усовершенствовал количественный химический анализ, но и дал ему теоретическое обоснование. Независимо от М. В. Ломоносова, некоторые работы которого долгое время оставались неизвестными западноевропейским учёным, А. Л. Лавуазье экспериментально доказал, что масса веществ при химических реакциях всегда остаётся постоянной.
Способствуя установлению важных закономерностей, количественный метод исследования привёл к бурному развитию химии. Список элементов стал постепенно уточняться, ошибочные “элементы” обнаруживали сложную природу. Основываясь на результатах своих многолетних экспериментальных исследований, А. Лавуазье описал и систематизировал все известные в то время химические элементы и разработал кислородную теорию горения и дыхания. В 1789 г. учёный опубликовал ставший знаменитым “Элементарный учебник химии”, в котором блестяще обобщил все достижения химии того времени.
Дальнейшее развитие химической науки сдерживалось, однако, тем, что отсутствовало общепринятое мнение о составе чистых веществ. Учёные точно не знали, обладает химическое соединение двух элементов А и В постоянным составом AmBn с определёнными значениями m и n или же переменным составом АхВу с изменяющимися х и у. Вскоре на этот вопрос были даны два противоположных ответа. Известный французский исследователь Клод Луи Бертолле, проанализировав ряд сплавов и осадки солей в природных растворах, установил, что состав веществ может непрерывно меняться в зависимости от внешних условий, и сделал отсюда вывод, что химические соединения имеют переменный состав, а постоянный состав отдельных чистых веществ является частным случаем химического взаимодействия.
Свои исследования К. Бертолле опубликовал в 1799—1801 гг. Одновременно, и тоже во Франции, появились работы Луи Жозефа Пруста, который на основании результатов тщательного анализа карбоната меди и оксидов меди и олова пришёл к выводу о постоянстве состава индивидуальных химических соединений независимо от способа их получения. Завязалась оживлённая научная дискуссия, которая длилась около десяти лет. Она закончилась победой Л. Пруста и установлением закона постоянства состава: любое чистое вещество, независимо от способа его получения, имеет постоянный состав.
Однако время показало, что оба учёных были правы. Наряду с соединениями, имеющими постоянный состав, существуют вещества переменного состава. Они названы в честь К. Бертолле "бертоллидами". Бертоллиды широко распространены в природе: к ним относятся, например, многие кристаллы и сплавы.
Одновременно с появлением атомно-молекулярной теории Дальтона — Авогадро перед учёными встал вопрос о взаимном расположении атомов в молекулах простых и сложных веществ.
В 1852 г. английский химик Эдуард Франкланд разработал учение о валентности. Он определил валентность как способность атомов одного элемента соединяться с определённым числом атомов другого элемента. За единицу её измерения была принята валентность атома водорода. В конце 50-х годов прошлого века немецкий учёный Август Фридрих Кекуле показал, что валентность В элемента есть частное от деления его атомной массы А на эквивалент Э:
B=A/Э
В 1858 г. А. Кекуле и молодой шотландский химик Арчибальд Скотт Купер независимо друг от друга установили четырёхвалентность углерода и высказали предположение, что в органических соединениях атомы углерода могут соединяться между собой с образованием цепочек типа
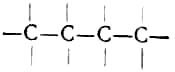
Для предельных углеводородов А. Кекуле вывел общую формулу CnH2n+2.
В 1861 г. русский химик-органик Александр Михайлович Бутлеров высказал принципиально важное положение, что в химическом соединении каждый атом связан непосредственно (с помощью устойчивых и относительно закреплённых связей) или косвенно (через взаимное влияние) со всеми остальными атомами. Он выдвинул представление о “химическом строении” молекул как о порядке межатомных связей в них и сформулировал основное положение теории химического строения: химические свойства молекулы определяются природой составляющих её атомов, их общим количеством и порядком связи друг с другом.
Блестящим подтверждением правильности взглядов А. М. Бутлерова явилось объяснение некоторых случаев изомерии взаимным влиянием не связанных непосредственно атомов. В 1864 г. А. М. Бутлеров получил третичный бутиловый спирт (СН3)3С—ОН, существование которого было предсказано Германом Кольбе, теоретически вывел возможные формулы спиртов, содержащих от одного до пяти атомов углерода, и получил некоторые из них. Далее он предсказал существование изомерии предельных углеводородов и синтезировал все изомеры, имеющие состав С4Н10. Один из немногих в то время сторонников новой теории — Эмиль Эрленмейер предложил для непредельных углеводородов формулы с двойными (С=С) и тройными (С=С) углерод-углеродными связями.
Большой вклад в развитие теории химического строения внёс немецкий химик-органик, близкий друг К. Маркса и Ф. Энгельса — Карл Шорлеммер. В отличие от большинства своих современников этот учёный был сознательным сторонником диалектического материализма 5. Именно знание диалектики и умение применить её в конкретной области естествознания позволили К. Шорлеммеру заложить экспериментальную основу современной органической химии. В 1864 г. он установил, что в предельных углеводородах все четыре связи атома углерода равноценны. Значение этого открытия видно из следующего. До К. Шорлеммера учёные считали, что в природе существуют два различных вещества: СН3—СН3 и C2H5—Н; он же экспериментально доказал, что оба эти вещества представляют собой одно и то же, а именно — этан с совершенно одинаковыми атомами углерода и одинаковыми атомами водорода. Тем самым была установлена правильность предложенной А. Купером структурной формулы этана
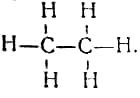
Открытие К. Шорлеммера позволило ввести современные структурные формулы и разработать номенклатуру органических соединений. В последующие годы учёный изучил весь ряд предельных углеводородов и их простейших производных до октана включительно. Оценивая значение этих работ, Ф. Энгельс писал: “Тем, что нам сейчас известно об этих парафинах, мы обязаны главным образом Шорлеммеру. Он исследовал имеющиеся вещества, принадлежащие к ряду парафинов, отделил одни от других и многие из них впервые получил в чистом виде; другие вещества, которые теоретически должны были существовать, но в действительности не были ещё известны, были открыты и получены также им. Таким образом, он стал одним из основоположников современной научной органической химии”6.
В 1866 г. А. Кекуле распространил теорию химического строения на ароматические соединения. В частности, им была предложена знаменитая формула бензола!
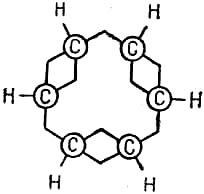
Впоследствии изменился лишь способ её написания. Однако ни формула Кекуле, ни другие её варианты не смогли объяснить некоторые, очень важные, свойства бензола. Причина особого химического поведения ароматических соединений оставалась загадкой вплоть до создания современной теории химической связи.
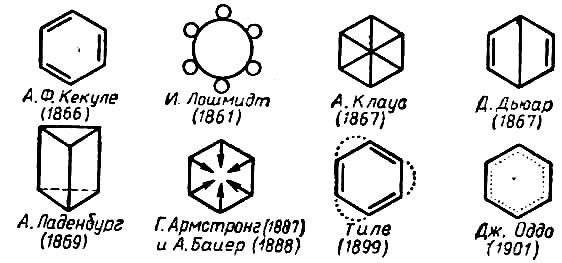
В 70-е годы прошлого века теория химического строения обогатилась представлениями о пространственном расположении атомов в молекулах органических соединений. Голландский химик Якоб Хендрик Вант-Гофф выдвинул гипотезу, смысл которой заключался в следующем: химические связи атома углерода равномерно распределены в пространстве и направлены от центра правильного тетраэдра к его четырём вершинам. Эта гипотеза получила впоследствии теоретическое обоснование и была подтверждена экспериментально.
Философы полагают, что факты рождают идеи, и в некотором смысле это верно. Но я нахожу в истории естествознания следующее: для того, чтобы понимать факты, необходимо иметь в голове определённые идеи и что глазами можно не увидеть того, что увидит разум7.
Ю. Либих
Начиная с 1888 г. в научном журнале Русского физико-химического общества стали появляться статьи с изложением оригинальных взглядов на структуру атомов. Автор этих статей — известный в то время философ Борис Николаевич Чичерин рассматривал атом как сложную систему, состоящую из положительно заряженной центральной массы и окружающих её отрицательных оболочек. Частицы с отрицательным зарядом (электроны) обладали, по его мнению, наибольшей подвижностью, а общее число оболочек возрастало с увеличением атомной массы элемента.
К идее планетарного строения атома, в основных чертах совпадающей со взглядами Б. Н. Чичерина, пришёл в 90-х годах прошлого века также и другой русский учёный — Николай Александрович Морозов.
В 1901 г. французский физико-химик Жан Батист Перрен опубликовал в журнале Review scientifique статью, где представил атом состоящим из “положительно заряженного ядра, окружённого отрицательными электронами, которые двигаются по определённым “орбитам” со скоростями, соответствующими частотам световых волн”8. Другими словами, Ж. Перрен в 1901 г. теоретически построил будущую экспериментальную модель Резерфорда. Однако эта его идея оказалась преждевременной, поскольку вопрос о носителе положительного заряда в атоме был ещё неясен.
На рубеже XIX и XX вв. широко развернулось изучение рассеяния электронов тонкими металлическими пластинками. Опыты показали, что при прохождении через фольгу электроны рассеиваются на малые углы. Для объяснения этого явления английский физик Уильям Томсон предложил рассматривать атом как облако положительного электричества с вкраплёнными в него электронами, которые находятся в некоторых устойчивых положениях, но могут смещаться и совершать колебания под действием внешнего электрического поля (рис. 5, а). Простейший атом — атом водорода с точки зрения модели У. Томсона представлял собой положительно заряженный шар, в центре которого находится электрон.
В отличие от своего соотечественника, Дж. Томсон считал, что электроны внутри положительного шара расположены в одной плоскости и образуют концентрические кольца (рис. 5, б). Возникновение химической связи он объяснял переходом электронов от одного атома к другому. Дж. Томсон впервые попытался связать периодичность в изменении свойств элементов со строением их атомов. Он также предположил, что общее число электронов в атоме непрерывно возрастает при переходе от элемента к элементу.
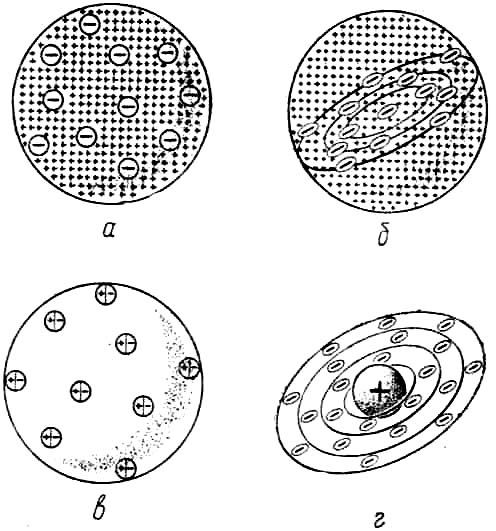
Рис 5. Первые модели атома: а —У. Томсона (1902); б — Дж. Томсона (1904); в — Ф. Ленарда (1904); г — X. Нагаоки (1904).
Немецкий физик Филипп Ленард отрицал возможность раздельного существования в атоме противоположных электрических зарядов. Согласно его модели, атом состоит из нейтральных частиц, каждая из которых является электрическим дуплетом (рис. 5, в). Выполненные Ф. Ленардом расчёты показали, что эти частицы обладают очень малым радиусом (3·10-12 см) и, следовательно, бóльшая часть атома пуста.
Для объяснения характера оптических спектров и явления радиоактивности профессор физики Токийского университета Хантаро Нагаока предложил в 1904 г. свой вариант атомной модели, в котором атом уподоблялся планете Сатурн. Роль самой планеты играл положительно заряженный шар — основная часть атома, вокруг которого, как расположенные в виде колец спутники Сатурна, вращаются электроны (рис. 5, г).
Чтобы окончательно решить вопрос о распределении положительного заряда в атоме, Э. Резерфорд предложил изучить рассеяние α-частиц металлической фольгой. К этому времени был уже изобретён спинтарископ — прибор для визуального подсчёта α-частиц. Попадая на экран, покрытый сульфидом цинка ZnS, они вызывали маленькие вспышки света — сцинтилляции, которые можно было наблюдать через увеличительное стекло.
Теоретическая гармония царит в периодической системе по третий период включительно. Далее начинаются отступления от строгой последовательности заполнения электронами энергетических подуровней. Например, в атомах хрома, меди, молибдена, серебра и золота наблюдается “провал” наружного s-электрона на внутренний подуровень (n—1)d. И вместо ожидаемой конфигурации (п—1)dкns2 появляется группировка (п—1)dк+1ns1. В атомах палладия наружный s-подуровень вообще отсутствует. Оба s-электрона ушли в глубь электронной оболочки, на d-подуровень. В результате общее число квантовых слоёв уменьшилось на единицу и перестало совпадать с номером периода. Правда, это единственное исключение подобного рода во всей периодической системе.
Электронная оболочка лантана (Z=57) не содержит f-электронов, что противоречит правилу Ю-Та. Лантан не включают в f-семейство, считая его d-элементом в полном соответствии с конфигурацией 4f05d16s2, которая присутствует в его атомах. Однако лютеций с электронной конфигурацией 4f145d16s2 относят к лантаноидам, т. е. к f-семейству, хотя с точки зрения строения электронной оболочки это неверно. Аналогичная картина наблюдается в случае актиния (5f06d17s2) и лоу-ренсия (5f146d17s2). В атомах тория должна присутствовать группировка 5f2, однако оба 5f-электрона переходят в 6d-подуровень. Несмотря на это, торий из соображений гармонии причисляют к семейству актиноидов — элементов с заполняющимся 5f-подуровнем.
Таким образом, мы видим, что граница раздела между d- и f-элементами оказывается размытой. Это объясняется близостью энергий соседних d- и f-подуровней. Главным следствием такого размытия границ является нарушение периодичности в системе Д. И. Менделеева. Так, например, согласно теоретическим ожиданиям, актиноиды, как аналоги лантаноидов, должны быть близки между собой по химическим свойствам. В действительности же торий, протактиний, уран, нептуний и плутоний совершенно не похожи ни на актиний, ни на своих последующих .соседей.
Следовательно, распределение электронов в атомах по энергетическим подуровням не всегда оказывается достаточным для характеристики химического поведения элементов и установления их места в периодической системе. Для этого необходимо принципиальное рассмотрение фундаментальных свойств элементов. Сторонником такого подхода был и Д. И. Менделеев, который помещал Th, Pa и U в побочные подгруппы IV, V и VI групп как аналоги, соответственно, гафния, тантала и вольфрама.
В 1951 г. австрийский исследователь П. Шенк предложил ввести вторые побочные подгруппы в структуру периодической системы и разместить в новых подгруппах лантаноиды и актиноиды. Это его предложение принято не было.
В 1969 г. советские учёные В. И. Спицын, Н. Н. Крот и А. Д. Гельман высказали идею о целесообразности помещения нептуния и плутония в специальные третьи подгруппы VII и VIII групп, так как было доказано, что эти элементы проявляют наивысшую степень окисления +7.
Против объединения элементов от тория до лоуренсия в одно семейство очень активно выступал М. Гайсинский во Франции. Он писал, что рассматривать все эти элементы как химические аналоги лантаноидов, — “значит порождать достойный сожаления беспорядок и наносить ущерб роли периодической системы как руководителю сложному, но надёжному в лабиринтах неорганической химии”9.
Дата установки: 01.12.2009
[