Рис. 5. Система Д. И. Менделеева о “порядковыми числами” И. Ридберга. 1906 г.
[вернуться к содержанию сайта]
Если рассматривать историю ядерной физики ретроспективно, то легко заметить, что феномен радиоактивности, открытый А. Беккерелем в 1896 г., был уже вторым свойством ядра, ставшим известным науке. Ранее в течение почти девяноста лет изучались атомные веса, т. е., по современным представлениям, линейные функции масс ядер. И хотя ни во времена Беккереля, ни тем более раньше ещё не был известен объект исследований (атомное ядро), изучение величин атомных весов, как будет показано далее, было не менее важным для возникновения будущей ядерной физики, чем изучение радиоактивности. Проблема атомных весов возникла в химии в первом десятилетии прошлого века. Её решение шло по двум основным направлениям – собственно определение атомных весов отдельных элементов и сравнительное изучение определяемых величин.
Первое направление можно назвать химическим. Его основу на протяжении всего XIX и первой четверти XX в. составляли химический эксперимент (позднее – методы масс-спектроскопии), приводивший ко всё более точному определению атомных весов, и все работы по классификации химических элементов, включая разработку периодической системы Д. И. Менделеева.
Второе направление исследований по своей сути является нехимическим (его можно было бы назвать также ядерно-физическим), поскольку ни одна из обнаруженных здесь закономерностей, как это стало понятно позже, не могла быть объяснена в рамках чисто химических представлений, а атомный вес непосредственно не связан с химическими свойствами элементов. Суть этого направления – сравнительное изучение собственно величин атомных весов как фундаментальной характеристики атомов. Мотивация его, с одной стороны, это попытка решить проблему внутреннего строения атома, что, по мнению учёных, было каким-то образом связано с величинами атомных весов, с другой – попытка найти закон изменения атомных весов, что позволило бы раз и навсегда решить очень важную для химии проблему их определения. Исходя из таких больших задач, кажется вовсе не удивительным, что это “нехимическое” направление исследований всегда находилось в центре внимания не только теоретической и экспериментальной химии, но и науки вообще. И нас оно будет интересовать в первую очередь, поскольку научное творчество А. Ван-ден-Брука было связано именно с развитием этого направления.
Рассмотрение оригинальной химической литературы, относящейся к этому направлению, позволяет выделить внутри него четыре самостоятельных направления, имеющих прямое отношение к последующему развитию ядерной физики, а именно: изучение проблемы целых чисел в образовании величин атомных весов, разработка идей о неаддитивности атомных масс, поиск аналитических зависимостей для изменения величин атомных весов в периодической системе и развитие представлений о порядковых номерах элементов в периодической системе [31]. С изучением творчества Ван-ден-Брука непосредственно связаны первое и особенно последнее направления.
Проблема целых чисел в образовании величин атомных весов была поставлена впервые гипотезой У. Праута в 1816 г. – его утверждением о целочисленности атомных весов в водородной шкале. Однако в результате довольно точных для своего времени определений Я. Берцелиуса и главным образом Ж. Стаса было показано, что большинство атомных весов не выражается целыми числами. Тем не менее целые числа вновь появились в истории анализа атомных весов.
В 1860 г. Ж. Мариньяк заметил, что “если числа Стаса и не согласуются вполне с числами Праута, то они тем не менее приближаются к ним до такой степени, что трудно считать этот факт случайным”. (Анализ величин атомных весов в XIX в. показывает, что эффект “близости к целым числам” был очень заметен уже в 40-е годы.) В дальнейшем Дж. Маллет (1882), И. Ридберг (1886). Г. Стретт (1901) количественно оценивали малую степень вероятности того, что наблюдаемая группировка атомных весов около целых чисел произошла случайно. Не менее важным было наблюдение, впервые сделанное, по-видимому, Ф. Кларком в 1881 г., о “лучшей целочисленности” атомных весов в кислородной шкале (O=16) по сравнению с водородной (H=1). Этот эффект был столь заметным, что, пожалуй, стал решающим аргументом в химии для перехода к кислородной шкале атомных весов. В 1882 г. Дж. Маллет и Ф. Кларк дали правильную оценку интервала близости атомных весов к целым числам – 0,1 атомной единицы массы (для современных атомных весов этот интервал равен 0,096 а. е. м.). Всё это давало право некоторым учёным считать, что существуют “более строгие основания верить в справедливость некоторой модификации закона Праута” (Г. Стретт, 1901).
Уже Праут в 1815 г. заметил, что “все элементарные числа [атомных весов], если за единицу принимать водород, делятся на 4”, и в связи с этим выдвинул мысль, что атомные веса как будто “ориентируются большим числом, чем единица, или водород”. В 1886 г. И. Ридберг [119] проанализировал округлённые до целых чисел атомные веса 23 лёгких элементов до железа и обнаружил, что они довольно чётко разделяются преимущественно на две группы – вида 4n (n – целое число) для 10 элементов чётной валентности и вида 4n+3 для 10 элементов нечётной валентности. Только водород и бериллий выпадали из такой закономерности. Ридберг построил функции отклонений атомных весов от целых чисел 4n и 4n+3 для всей периодической системы и получил при этом две почти подобные волнообразные кривые. Плавность кривых и их явную корреляцию он воспринял как доказательство “невозможности рассматривать элементы как простые и независимые друг от друга”, что “раньше не более как угадывалось”. Кроме того, он пришёл к выводу, что “атомные веса являются целыми кратными атомному весу водорода, но при этом содержат также второй периодический член δ”, характеризующий отклонение атомных весов от целых чисел.
“Главные массы атомов, – писал Ридберг, имея в виду целочисленные величины 4n и 4n+3, – или атомные ядра (Atomkerne), как можно было бы их назвать, должны быть целыми кратными массе ядра водорода. Проще всего предположить, что ядра остальных элементов составлены из ядер водорода. Если мы перейдём теперь к δ-значениям, то... наиболее вероятно, что ядра атомов окружены массами, соответствующими δ-значениям, как оболочками (Hüllen), величина которых была бы периодической функцией относительно величины ядер” [119, с. 16] (курсив Ридберга. – Ю. Л.). Это была своего рода модификация гипотезы Праута по Ридбергу на новом уровне точности определений атомных весов. Выраженная им идея – не только терминологическое, но и довольно точное качественное предвосхищение будущего знания.
Вслед за Ридбергом группировку атомных весов около целых чисел 4n и 4n+3 исследовали А. И. Базаров (1887), У. Ливермор (1888), Р. Лоренц (1896), С. А. Никольский (1910), Т. Вулф (1911) и др. К вопросу о целочисленности атомных весов относятся предвосхищения изотопии, принадлежащие А. Кекуле (1865) и У. Круксу (1886) [55, 59].
Из упомянутых работ наибольший интерес в связи с изучением творчества А. Ван-ден-Брука представляет работа Т. Вулфа “Радиоактивность как всеобщее свойство веществ” [131]. Это была единственная работа по анализу величин атомных весов, на которую Ван-ден-Брук сослался в своих статьях.
На основе международной таблицы 1911 г. Вулф показал, что атомные веса “с приближением, которое не может быть случайным, выстраиваются в два ряда..., отдельные члены которых отличаются друг от друга на четыре единицы или числа, кратные четырём” (4n и 4n–1). Отсюда Вулф сделал главный вывод, что “явление радиоактивности не ограничивается несколькими веществами, но что вся наша система элементов возникла в итоге атомного распада из более тяжёлых элементов”. Не менее любопытны и другие выводы Вулфа: “разная распространённость элементов... является просто следствием различной продолжительности жизни элементов” и “атом гелия должен играть выдающуюся роль в нашем мире веществ; ...если всегда отделяется один атом гелия, то отдельные части его крепче связаны друг с другом, чем целиком атом гелия с остальной массой распадающегося атома” [131, с. 499–500].
В работе Вулфа содержались ссылки на работы И. Ридберга [119, 120] и Р. Лоренца [95], однако у нас нет никаких доказательств того, что Ван-ден-Брук видел эти работы. Во-первых, на них у него нет ссылок. Во-вторых, и это главное, логика его научного творчества показывает, что его идеи развивались независимо не только от идей и работ Ридберга, но и всех работ рассматриваемого нами нехимического направления исследований. Единственным исключением здесь является работа Вулфа, результаты которой Ван-ден-Брук использовал. В остальном его идеи развивались по-новому и независимо от предшествующей истории анализа атомных весов. Это, разумеется, никак не влияет на место Ван-ден-Брука в этой истории, место, связанное главным образом с развитием представлений о порядковых номерах элементов в периодической системе.
В 1864–1865 гг. английский химик Дж. Ньюлендс [101], по-видимому, впервые заметил, что если расположить элементы в порядке увеличения их атомных весов и каждому элементу, начиная с водорода, приписать “номер” (number), то “восьмой элемент, начиная с данного, является своего рода повторением первого подобно восьмой ноте октавы в музыке”.
Глубоко веря в правильность своего так называемого закона октав, Ньюлендс писал в 1866 г.: “Факт, что такое простое соотношение существует, теперь дает веское основание предполагать, что это всегда будет сохраняться, даже если будут открыты сотни новых элементов. Ибо, хотя разность в номерах аналогичных элементов может измениться с 7 или кратного 7 на 8, 9, 10, 20 или любую возможную цифру, существование простого соотношения номеров сходных элементов не может быть менее очевидным” [101, с. 20].
Таблица 1. “Закон октав” Дж. Ньюлендса. Август 1865 г.
|
H 1 |
F 8 |
Cl 15 |
Co и Ni 22 |
Br 29 |
Pd 36 |
I 42 |
Pt и Ir 50 |
|
Li 2 |
Na 9 |
К 16 |
Сu 23 |
Rb 30 |
Ag 37 |
Cs 44 |
Tl 53 |
|
G 3 |
Mg 10 |
Ca 17 |
Zn 25 |
Sr 31 |
Cd 38 |
Ba и V 45 |
Pb 54 |
|
Во 4 |
А1 11 |
Cr 19 |
Y 24 |
Се и La 33 |
U 40 |
Та 46 |
Th 56 |
|
С 5 |
Si 12 |
Ti 18 |
In 26 |
Zr 32 |
Sn 39 |
W 47 |
Hg 52 |
|
N 6 |
P 13 |
Mn 20 |
As 27 |
Di и Mo 34 |
Sb 41 |
Nb 48 |
Bi 55 |
|
O 7 |
S 14 |
Fe 21 |
Se 28 |
Ro и Ru 35 |
Te 43 |
Au 49 |
Os 51 |
Вначале Ньюлендс присваивал один номер нескольким элементам с равными или близкими атомными весами. С 1875 г. он каждому элементу присваивал отдельный номер, который стал называть “порядковым номером” (ordinal number).
Ньюлендсу принадлежат первые попытки оперировать с порядковыми номерами и атомными весами. Так, распределяя все элементы в октавы по семь элементов с правильно чередующимися валентностями и с закономерно возрастающими атомными весами, он получил таблицу элементов с 112 местами, незанятые 43 места в которой, по его мнению, могли бы быть заполнены ещё неоткрытыми элементами или известными элементами с неточными атомными весами. Ньюлендс также делил атомные веса элементов на специально подобранные числа 2,3 (шкала Na=10), 2,4 (шкала С=5,00 или Mg=10,00) и 2,37 (шкала С1=14,98) так, что у него получались частные, приблизительно равные порядковым номерам, особенно в начале системы.
Как уже было отмечено, Ньюлендс не закреплял порядковые номера за элементами. Единственный смысл, который он им придавал, – служить своеобразной масштабной шкалой для выражения “закона октав”. Ньюлендс неоднократно выступал с заявлением о приоритете в открытии периодического закона. Возможно, именно это последнее обстоятельство стало главной причиной того, что идея о порядковом номере не была сразу связана с периодической системой Менделеева. Добавим, что идея Ньюлендса о порядковых номерах элементов была подвергнута обструкции английскими химиками. Вспомнили о ней лишь после раскрытия физического содержания понятия о порядковом номере.
Вслед за Ньюлендсом наибольшего успеха в разработке понятия порядкового номера достиг И. Ридберг. Уже в первой своей работе о периодической системе (1885) он обратил внимание на попеременные колебания разностей атомных весов соседних элементов в группах и рядах системы. Он предположил, что атомные веса могут рассматриваться как периодические функции их порядковых номеров (ordningsnummer, швед.).
Через год, исходя из обнаруженной концентрации атомных весов лёгких элементов около чисел видов 4n и 4n+3, Ридберг писал: “Важнейшим результатом наших исследований является впервые приобретённое знание чисел … n, через которые можно будет рассматривать все свойства элементов, а также их соединений как функции натурального ряда чисел вместо атомных весов, которые никогда не смогут полностью освободиться от ненадёжности экспериментального наблюдения” [119, с. 18]. Исходя из полноты атомных весов по числам вида N=4n и N=4n+3, Ридберг предположил существование элементов с атомными весами 4, 20, 36, 72, 80 и т. д. Элементы с приблизительно такими атомными весами были вскоре открыты (Не, Ne, Ar, Ge).
Аргументация в пользу введения порядковых номеров в периодическую систему элементов Менделеева была приведена Ридбергом в 1897 г. [120]. В основе её лежали два положения. Во-первых, средние разности атомных весов соседних элементов приблизительно постоянны и равны примерно 2,40, т. е. в первом приближении можно считать, что атомные веса элементов пропорциональны их порядковым числам. Во-вторых, “если обозначить через М порядковое число элемента, то элементы с нечетным М обладают нечётной валентностью и нечётным N=2M+1, а элементы с чётным М – чётной валентностью и чётным N=2M”.
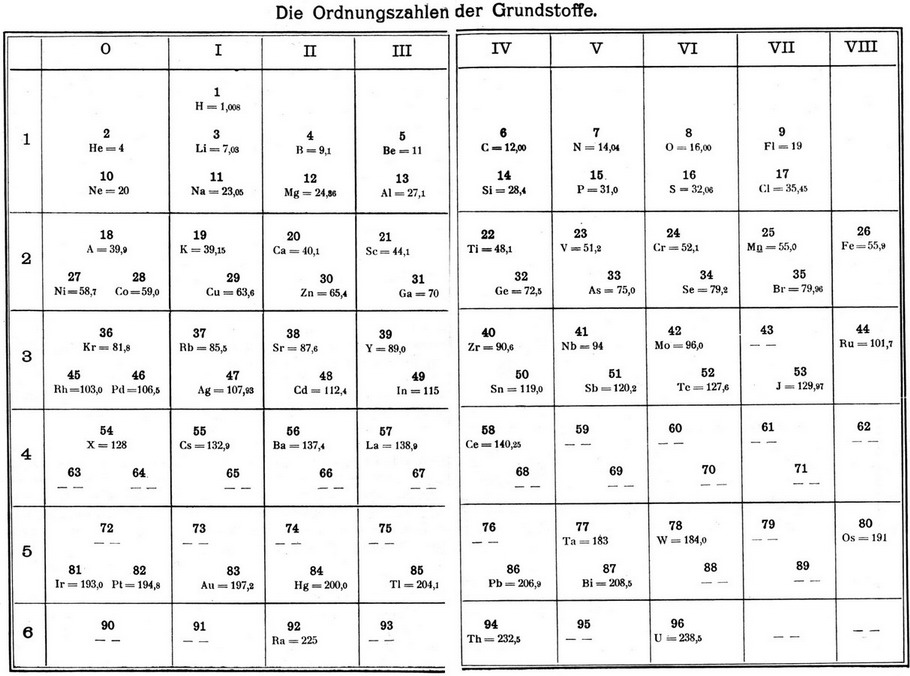
Найденная связь порядковых номеров и атомных весов вида N=4n, 4n+3 кажется учёному многообещающей: “Едва ли можно сомневаться, что мы имеем здесь дело с закономерностью, которая несёт на себе настоящий отпечаток некоего закона природы и отмечена простотой, какую можно ожидать у первых кирпичиков природы” [120, с. 91–92]. Нетрудно, однако, видеть, что такая аргументация Ридберга была математической в своей основе. Вопрос о физическом содержании понятия не был даже поставлен. В 1906 г. Ридберг окончательно отказался от основного положения периодического закона – явной зависимости свойств элементов от атомных весов – и впервые опубликовал [121] систему элементов Менделеева с “порядковыми числами” (Ordnungszahlen) (рис. 5).

Рис. 5. Система Д. И. Менделеева о “порядковыми числами” И. Ридберга. 1906 г.
Порядковые числа Ридберга отличались от современных порядковых номеров только в двух позициях. Кобальт и никель имели обратное расположение, хотя К и Аr, Те и I – правильное. Для редкоземельных элементов от церия до тантала было оставлено 18 мест вместо 14.
Дополнительными аргументами Ридберга для такой нумерации элементов были: “законность и нерушимость” периодической системы Менделеева, закономерное повышение на единицу положительной валентности в рядах, приблизительно одинаковая разность атомных весов, приходящаяся на каждый период (~45). Ридберг особо оговорил невозможность включения новых элементов между Н и Не, а также между Не и Li, мотивируя это тем, что включение сюда новых элементов нарушило бы “простое правило”: N=2M для чётных и N=2M+l для нечётных элементов.
Следующая работа Ридберга появилась только в сентябре 1913 г. Эволюция его представлений о порядковом числе коснулась нескольких моментов. Прежде всего окрепла сама гипотеза о порядковом числе: “В менделеевской системе все элементы расположены в один ряд, и каждый элемент отличается от всех остальных своим местом. Но это означает, что достаточно одной-единственной независимой переменной для полного определения элемента” [122, с. 3]. В его новой таблице (рис. 6) кобальт уже располагается перед никелем. Впервые Ридберг размещает в периодической системе все редкоземельные элементы. Причём, что очень важно, он правильно находит их общее количество и их последовательность.
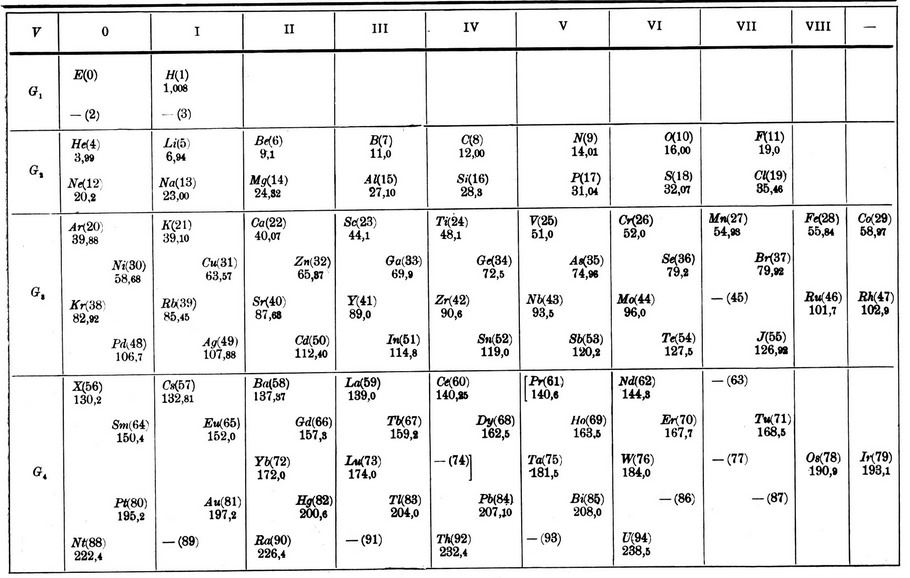
Рис. 6. Система Д.И. Менделеева с "порядковыми числами" И. Ридберга. 1913 г.
Количество редкоземельных элементов ему удалось определить, исходя из представлений о так называемых Gp-группах: число элементов в группе Gp равно 4р2, а число элементов в половине группы 2р2 (р=1, 2, 3 ...). Следовательно, в G4-rpynne, содержащей редкоземельные элементы, должно быть 64 элемента, а в её половине, т. е. соответствующем периоде системы элементов, – 32. Отсюда получалось число редкоземельных элементов – 14.
Однако структура Gp-гpупп привела к необходимости принять для G1-группы число элементов, равное 4. Поэтому вопреки своей прежней точке зрения Ридберг всё же ввёл в систему гипотетические элементы до гелия: электрон, который он считал элементом с порядковым числом 0, а также короний и небулий с порядковыми числами соответственно 2 и 3. В результате оказалось, что при правильной с современной точки зрения последовательности всех элементов начиная с гелия их порядковые номера получились завышенными на две единицы. Например, гелий имел порядковое число 4, уран – 94. В дальнейшем представления Ридберга о таких порядковых числах не изменились.
В заключение отметим, что понятие порядкового номера возникло и трактовалось в работах Ньюлендса без какой-либо связи с периодической системой Д. И. Менделеева. В этом состоит главный недостаток эмпирического подхода Ньюлендса к анализу величин атомных весов. Поэтому он в принципе не мог увидеть аномальное изменение атомных весов, предсказать хотя бы близкое к правильному количество ещё не открытых элементов, указать правильные порядковые номера.
Ридберг, наоборот, всегда проводил математический в своей основе анализ величин атомных весов, исходя из периодической системы элементов как единого целого, глубокие и многочисленные связи элементов в котором опирались на фундамент всей химии. Успех, достигнутый им в определении порядковых номеров, в значительной степени был обусловлен таким подходом. С точки зрения истории порядковых номеров именно Ридберг после появления модели атома Резерфорда должен был соединить это понятие с новой физической реальностью – величиной заряда ядра. Однако Ридберг не сделал этого из-за нигилистического отношения к современному ему знанию. В своих работах Ридберг никак не откликнулся на открытия радиоактивности, изотопии, атомного ядра, боясь, по его признанию, “потерять свободный взгляд на вещи”.
Соединить порядковые номера элементов с моделью атома Резерфорда и раскрыть их физический смысл удалось только Ван-ден-Бруку, который совершил это почти независимо от предыдущей истории порядковых номеров.
Эта самая большая и, пожалуй, наиболее важная статья Ван-ден-Брука поступила в редакцию “Physikalische Zeitschrift” 15 ноября 1912 г. и была опубликована в выпуске журнала от 1 января 1913 г. Статья содержала рекордное для научных работ Ван-ден-Брука число ссылок – 32, что значительно выделяется на среднем уровне – примерно 6 ссылок на работу. Важность статьи определяется тем, что в ней не только независимо было введено понятие “порядковый номер”, но и был найден и всесторонне обоснован физический эквивалент этого понятия.
Хотя статья состоит из четырёх разделов, она, по существу, распадается на две части.
Первая часть посвящена обоснованию нового, уже третьего варианта системы элементов, который Ван-ден-Брук называет “расширенной” системой. Необходимость введения новой системы он видел в том, что она допускает “более простое решение” проблемы размещения элементов по сравнению с “кубической” на основе новых данных о числе редкоземельных и радиоактивных элементов. На самом же деле это было компромиссное решение, значительно сближавшее структуру расширенной системы, которая сохраняла основные идеи Ван-ден-Брука, с менделеевской системой.
Расширенная система показана на рис. 11. Ван-ден-Брук впервые оставляет неизменной структуру менделеевской системы как целого (“система как целое может остаться почти неизменной”), позволяя себе вносить изменения лишь в неясных её частях. В нулевой группе перед инертными газами начиная с аргона он оставляет по одному свободному месту в соответствии с тем, что радиоактивные эманации тория и радия занимают два места в последнем горизонтальном ряду. В клетки III группы он помещает попеременно по одному и по два элемента в связи с тем, что, по его предположению, радиоторий и ионий должны занимать одну клетку в последнем ряду.
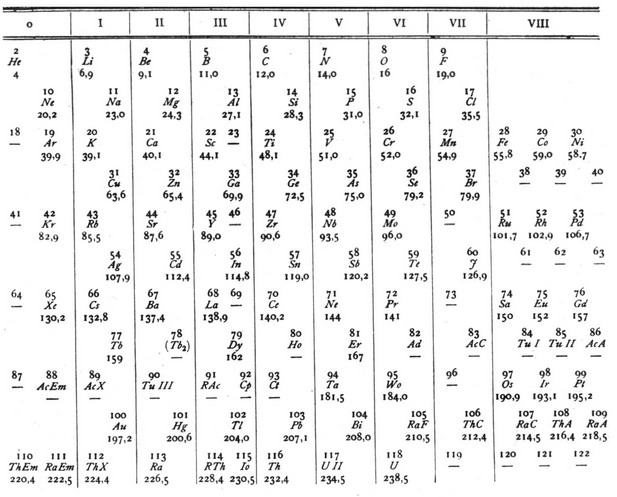
Рис. 11. “Расширенная” система элементов А. Ван-ден-Брука. 1 января 1913 г.
Каждую строку VIII группы начиная с Fe-группы он также считает состоящей из трёх мест в связи с предполагаемой сложностью последних строк, необходимой для размещения радио- и редкоземельных элементов. Редкоземельные элементы располагались подряд вслед за лантаном, чередуясь с радиоэлементами актиниевого ряда. Такого симметричного расширения периодической системы, по мнению Ван-ден-Брука, было достаточно, чтобы вместить в неё “истинные” 14 радиоэлементов радиевого и ториевого рядов и 5 радиоэлементов актиниевого ряда. Поскольку уже в менделеевской системе существуют триады VIII группы, то он не видел ничего противоречивого в том, что аналогичные триады и диады могут появиться и в других частях системы.
“Истинными” элементами Ван-ден-Брук считал по-прежнему только α-излучатели, различающиеся по атомному весу. “Обычные атомы являются нейтральными образованиями, составными частями которых должны рассматриваться именно заряженные частицы, – писал он, – они не могут стать другими атомами в результате потери одного заряда одного знака без одновременного изменения массы (массой электрона пренебрегаем). Ионы и соответствующие нейтральные атомы различаются по свойствам, и это различие будет проявляться в ещё более значительной мере при потере других, более сильно связанных электронов. По сравнению с этим новыми элементами, т. е. опять нейтральными атомами других весов, могут считаться только те, которые возникают в результате потери обоих видов заряда с соответствующим изменением массы”. По мнению Ван-ден-Брука, β-излучатели должны рассматриваться, “как это считает и Рамзай”, в качестве “псевдоэлементов”, т. е. побочных форм α-излучающих элементов того же атомного веса [4, с. 33].
Такая позиция фактически исключала Ван-ден-Брука из числа авторов (К. Фаянс, Ф. Содди, Г. Хевеши и др.), которые одновременно искали правильное решение проблемы размещения радиоэлементов для всей их совокупности. Кроме того, тезис об определяющей роли массы для характеристики “нового” элемента уже противоречил установленному к 1912 г. факту существования ряда химически тождественных и спектроскопически идентичных радиоэлементов. Этот факт был отмечен Ван-ден-Бруком, но только для подтверждения своей расширенной системы: “В новых нулевом и III рядах и при новых элементах VIII ряда мы находим поразительную схожесть помещённых вместе элементов. Для обеих эманаций это само собой разумеется. Но и ионий, как известно, очень похож на радиоторий (как на сам торий). То же самое справедливо и для обоих А-продуктов, точно так же для обоих С-продуктов” [4, с. 34]. Однако применённый им принцип – помещение “поразительно схожих элементов” в одну группу системы – не был выдержан до конца. Возможно потому, что у Ван-ден-Брука не было полных сведений о таких элементах, но главным образом потому, что даже при их наличии помещение схожих элементов в соответствующую группу (клетку) системы вступило бы в противоречие с ходом изменения атомных весов и с его пониманием периодичности для системы в целом. Во всяком случае зародыш такого принципа содержался в его статье.
Ещё одно исходное положение Ван-ден-Брука – закономерное изменение атомных весов в расширенной системе: он опять использовал понятие “теоретические атомные веса”, а также то, что разности атомных весов соседних элементов были примерно равны двум. Но на этот раз в роли теоретических атомных весов выступали числа видов 4n и 4n+3 (n – целое число) (рис. 12), заимствованные из работы Т. Вулфа 1911 г. [131]. Разность теоретических атомных весов соседних элементов равна двум теперь уже в среднем и близка к такой разности во всех периодах расширенной системы “даже ещё в большей степени”, чем в менделеевской. Суммы теоретических и измеренных атомных весов, взятые по отдельности, совпадают с точностью 0,22%. Приблизительно одинаковы разности атомных весов, приходящиеся на каждый период. Иначе говоря, новая система Ван-ден-Брука по-прежнему удовлетворяла его представлениям о периодичности.
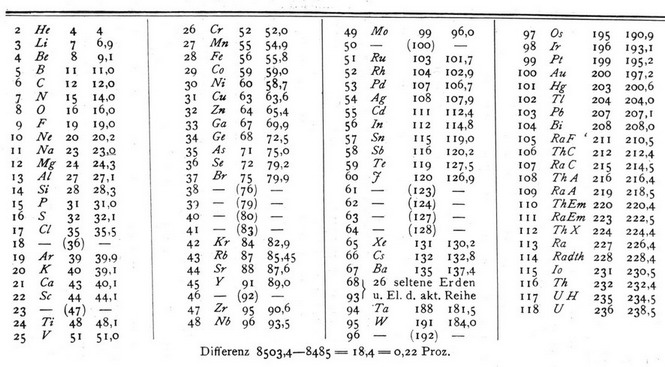
Рис. 12. Таблица, на основе которой Ван-ден-Брук ввёл порядковые номера элементов в расширенной системе. 1 января 1913 г. (слева от символа элемента приведён порядковый номер, справа – теоретический и "измеренный" атомные веса).
Интересным примером богатства идей, содержащихся в работах Ван-ден-Брука, могут служить его аргументы в отношении размещения в расширенной системе радиоэлементов актиниевого ряда: “Если актиниевый ряд, как это часто считается, должен быть побочным рядом уран-радиевого ряда, то здесь должен иметь место не простой выброс α- или β-лучей, но распад производящего элемента на две части (так как согласно периодической системе атомные веса в актиниевом ряду должны быть значительно меньше). При этом возникает не один, а два ряда. Сумма теоретических атомных весов для начальных членов обеих "серий открытых мест" во всяком случае равна такой же сумме для элементов уран-радиевого ряда” [4, с. 35–36] (курсив наш. – Ю. Л).
Конечно, трудно считать это предвосхищением открытия процесса деления, но во всяком случае Ван-ден-Брук уже в 1913 г. имел в виду такую возможность. Неизвестно только, почему он считал, что атомные веса в актиниевом ряду должны быть столь низкими. Впрочем, далее в статье указывается, что члены актиниевого семейства могут принадлежать и другим радиоактивным рядам, представителями которых могут быть, например, радиоактивные калий и рубидий. К тому же продолжительность жизни таких радиоэлементов становится, “вообще говоря, тем короче, чем меньше атомный вес”, что затрудняет их идентификацию. Отсюда можно заключить, что размещение актиниевых радиоэлементов среди редкоземельных элементов сам Ван-ден-Брук считал не окончательным.
В работе [8] и в ответе Резерфорду и Содди от 25 декабря [7] Ван-ден-Брук ввёл термин “ядерные электроны”. Он выразил удивление, что его мысль о ядерных электронах оказалась “новой”. Учёный вновь, но уже в другой форме высказывался по поводу состава ядра: “Если [α]-частица, по всей вероятности, состоит из четырёх Н+-частиц и двух электронов, а частица Х3+ из трёх Н+-частиц и двух электронов, число электронов и Н+-частиц должно быть равно атомному весу. Но тогда диаметр положительной единицы определённо не может быть больше диаметра электрона (10–13 см). [Эта положительная единица], конечно, может быть также электроном, но в другом состоянии и быть частицей с чистым положительным зарядом” [7, с. 478]. Понятно, что это высказывание является, по существу, только новой редакцией приведённого выше высказывания из статьи “О ядерных электронах” [8], которая была опубликована лишь в марте 1914 г. Оно служит ещё одним доказательством того, что эта статья была написана Ван-ден-Бруком между 10 ноября и 4 декабря 1913 г.
Известно, сколь важной для развития ядерной физики была статья Резерфорда “Строение атома” [110], опубликованная в марте 1914 г. У нас нет прямых свидетельств, в какой мере Резерфорд использовал идеи Ван-ден-Брука. Однако анализ этой статьи, пожалуй, позволяет получить такие свидетельства, опираясь на то, что выше мы внимательно проследили все публикации Бора, Резерфорда и Ван-ден-Брука, посвящённые вопросу о строении атомного ядра. С этой целью рассмотрим новые идеи и выводы, впервые появившиеся в этой статье Резерфорда.
В первой части статьи описаны последние результаты, полученные сотрудниками Резерфорда. Эксперименты Гейгера и Марсдена “показали, что гипотеза о структуре атома в существенных чертах правильна”. (Отметим, что Резерфорд обходит в статье молчанием новую интерпретацию этих экспериментов, данную Ван-ден-Бруком 27 ноября 1913 г.) Ч. Дарвин теоретически показал, что формулы Резерфорда для рассеяния α-частиц практически не изменяются при учёте движения ядер отдачи даже для таких лёгких атомов, как атомы углерода, и что закон сил, действующих между α-частицей и ядром, есть закон обратной пропорциональности квадрату расстояния. Предварительные эксперименты Марсдена по рассеянию α-частиц в водороде указывали на то, что часть атомов водорода в результате столкновений с α-частицами получают скорости, согласующиеся с теоретически ожидаемыми.
Выводы второй части статьи [110], носившие теоретический характер, приведём по порядку, снабжая их необходимыми комментариями:
1. Резерфорд: “Из опытов Дж. Дж. Томсона и других хорошо известно, что никогда не наблюдались носители положительного электричества с массой, меньшей массы атома водорода. Обнаруженные чрезвычайно малые размеры ядра водорода (меньше обычно принимаемой величины диаметра электрона) подтверждают предположение, что ядро водорода есть положительный электрон и что его масса исключительно электромагнитного происхождения” [110, с. 242-243].
Ван-ден-Брук: “Дж. Дж. Томсон обнаружил у водорода (и только у него) никогда не больше, чем один заряд, у гелия – никогда не больше, чем два заряда в атоме... α-Частицы вряд ли могут быть единственными положительными носителями, так как атом гелия не есть легчайший атом... Н+-атом в качестве одновалентной положительной единицы может быть составной частью α-частицы” [4, с. 38, 41] (1 января 1913 г.); в ядре урана “380 частиц занимают объём около 2,7·10-35 см3. Поэтому положительная единица должна быть равного размера, если не идентична электрону (0,5·10-37), но в другом состоянии” [8, с. 457] (10 ноября – 4 декабря 1913 г.); “Диаметр положительной единицы мог бы быть не более чем диаметр электрона (10-13 см) и может, конечно, быть частицей с чистым положительным зарядом” [7, с. 478] (25 декабря 1913 г.).
Связь идей и аргументаций двух учёных очевидна. Особенно ясно это из введённого Резерфордом термина “положительный электрон”. Новым является его предположение о том, что масса ядра водорода – электромагнитного происхождения.
2. Резерфорд: “Если предположить, что положительный электрон, т. е. атом водорода, – это тот единичный элемент, из которого составлены все атомы, то следует ожидать, что атом гелия содержит четыре положительных и два отрицательных электрона” [110, с. 243].
Ван-ден-Брук: “В α-частице, входящей в атом, должны находиться, помимо [Н-атомов], ещё два электрона” [4, с. 38] (1 января 1913 г.); “Если бы α-частица состояла из четырёх Н+-частиц плюс двух электронов, тогда количество ядерных электронов для урана было бы равным 142, количество положительных единиц – 238” [8, с. 457] (10 ноября – 4 декабря 1913); “α-Частица, возможно, состоит из четырёх Н+-частиц и двух электронов, а Х3+-частица – из трёх Н+-частиц и двух электронов” [7, с. 478] (25 декабря 1913 г.). Выводы Ван-ден-Брука полнее – охватывают большее число ядер.
3. Резерфорд: “Ядро гелия – очень стабильная конфигурация, которая... представляет собой, по-видимому, одну из единиц, из которых построено большинство атомов. Радиоактивные явления показывают, что атомный вес последовательных продуктов при испускании α-частицы уменьшается на четыре единицы и, как часто указывалось, атомные веса многих стабильных атомов различаются примерно на четыре единицы” [110, с. 243].
Ван-ден-Брук: “То, что общий заряд ядра, так же как и масса, точно соответствует такому, какой полагался бы при [его] построении из α-частиц, едва ли может быть случайным. ...Носителями положительных зарядов внутри ядра относительно малого размера могли бы быть, пожалуй, в значительной мере α-частицы. Наряду с ними могут существовать всё же другие неизвестные носители... которые могли бы объяснять отклонения атомных весов [от целых чисел]...; Если распределить все округлённые до целых чисел атомные веса на четыре группы соответственно формулам 4n, 4n+1, 4n+2, 4n–1 (n – целое число), то почти все они попадут в группы 4n и 4n–1” (1 января 1913 г.); “Если известна правильная последовательность элементов в [радиоактивном] ряду, можно точно вычислить их атомные веса из количества и масс α-частиц” [4, с. 33, 36, 38, 41] (1 января 1913 г.).
Аргументация обоих учёных идентична. Новый вывод Резерфорда – “ядро гелия – очень стабильная конфигурация” – не имеет эквивалента у Ван-ден-Брука.
4. Резерфорд: “Поскольку эксперименты показывают, что ядро имеет очень малые размеры, то образующие его положительные и отрицательные электроны должны быть плотно упакованы. Как показал Лоренц, электрическая масса системы заряженных частиц... зависит от взаимодействия их полей... Упаковка должна быть очень плотной, чтобы создалось заметное изменение массы, обусловленное этой причиной. Этим, например, можно объяснить тот факт, что масса атома гелия не в точности равна учетверённой массе атома водорода” [110, с. 243].
Это целиком новый и очень важный вывод Резерфорда, опирающийся на теоретические работы Г. Лоренца. Ван-ден-Брук для объяснения отклонений атомных весов от целых чисел пошёл по ложному пути – предположил, что в ядре существуют ещё меньшие по массе, чем атом водорода, частицы с единичным положительным зарядом.
5. Резерфорд: “Возникает важный вопрос: содержат ли атомные ядра, которые все имеют положительный заряд, отрицательные электроны?.. Кажется обоснованным предположение, что и β-превращения есть следствия выброса отрицательного электрона из ядра” [110, с. 244].
Выше мы показали, что автором такого предположения был Ван-ден-Брук. Однако на него Резерфорд не ссылается, ограничившись упоминанием только Бора, который “на основании радиоактивных данных сделал вывод, что β-частицы большой скорости возникают в ядре” [110, с. 244].
6. Резерфорд: “Представляется невероятным, чтобы электроны внутри ядра вносили вклад в рассеяние [Х-лучей], так как они тесно связаны с положительным ядром и должны удерживаться в равновесии силами совершенно иного порядка величины, нежели силы, связывающие внешние электроны” [110, с. 224].
Это ещё один новый вывод Резерфорда, который в дальнейшем привёл к представлению о ядерных силах.
7. Резерфорд: “Из рассмотрения атомов водорода и гелия, где водород имеет один электрон, а гелий – два, очевидно, что число электронов не может быть всегда точно равно половине атомного веса. Это приводит к интересному предположению, которое высказал Ван-ден-Брук, что число единиц заряда ядра, а следовательно, число внешних электронов должно быть равно номеру места, которое занимает элемент по порядку возрастания атомного веса... Эта точка зрения была принята Бором в его теории строения простых атомов и молекул. Недавно это предположение дважды получило сильное подтверждение...” [110, с. 244–245]. (Резерфорд имел в виду июньскую (1913 г.) работу Содди и эксперименты Мозли.)
Автором этого “предположения” был Ван-ден-Брук, на которого Резерфорд здесь впервые ссылается, причем только на его статью от 1 января 1913 г. Резерфорд впервые (и почти без какой-либо аргументации) отказывается от своего соотношения Z≈A/2.
Таким образом, из семи впервые обсуждаемых Резерфордом теоретических идей и положений пять раньше него обсуждались Ван-ден-Бруком (кроме п. 4 и 6), причём с тремя позициями Ван-ден-Брука Резерфорд согласился целиком (п. 2, 5, 7), а в две внёс развитие (п. 1, 3). Целиком Резерфорду принадлежит идея ядерных сил (п. 6). Идея плотной упаковки частиц в ядре и связанная с ней идея неаддитивности атомных масс были инициированы работами Г. Лоренца.
Очевидно, что общее представление о составе ядра из Н+-атомов и ядерных электронов (после 1920 г.— протон-электронная модель атомного ядра) принадлежит Ван-ден-Бруку. Оригинальные идеи Резерфорда касались уже дальнейшего развития этого представления. Поэтому протон-электронную модель ядра можно с полным правом называть моделью Ван-ден-Брука – Резерфорда.
За год с небольшим была получена ценнейшая информация о ядре – величина его положительного заряда и представление о его составе с помощью вспомогательной гипотезы о ядерных электронах. Был открыт путь к ускоренному развитию ядерной физики. Началом этого пути стала работа Ван-ден-Брука от 1 января 1913 г. [4]. Он же стал “виновником” такого быстрого прогресса, заставив даже Резерфорда высказаться по всегда не любимым им теоретическим вопросам. “До тех пор пока ядерная теория не будет более определённо проверена, – писал Резерфорд в мартовской статье 1914 г., явно отдавая предпочтение эксперименту, – преждевременно обсуждать возможное строение самого ядра” [110, с. 243]. Примерно в том же духе он высказывался в 1920 г. [114, с. 313]. Но им же рождённое движение, мощный импульс которому придал в январе и ноябре 1913 г. Ван-ден-Брук, уже нельзя было остановить.
Научный портрет Ван-ден-Брука был бы незавершённым, если бы хотя бы вкратце не была раскрыта трагедия, на которую он обрёк себя после своего “звёздного” 1913 г. События последних девяти лет его жизни ещё раз свидетельствуют о глубоком, непреходящем и в полной мере бескорыстном служении истине, что всегда было основным содержанием всего его человеческого существа. Муки научного творчества этих долгих трудных лет не позволяют поверхностно и легковесно относиться к его творчеству в целом.
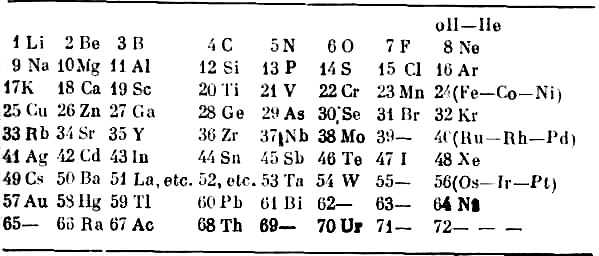
Таблица 3. “Сжатая” система элементов А. Ван-ден-Брука “с периодическими номерами 1–70”
Трагедия Ван-ден-Брука состояла в том, что он не остановился на своём открытии, а в течение ещё двух лет (1914–1915) довольно частых публикаций пытался пойти дальше и глубже того, что уже сделал. Основанием для этого служили, по его мнению, остающиеся “нерегулярности” в системе Менделеева, а также то, что развиваемая им “сжатая” модель системы элементов поначалу вроде бы давала лучшее согласие с экспериментом. Однако всё чаще он стал сталкиваться с обратным, стал убеждаться в том, что по инерции “пробежал” мимо истины. Однако ещё большая трагедия ожидала его впереди, когда он занялся разработкой вопросов изотопии. Здесь пока ещё слабые возможности эксперимента уже не могли оказать сдерживающего влияния. Поэтому, лишённый опоры, теоретический поиск Ван-ден-Брука был заранее обречён на неудачу; он взялся за решение задачи, время для которой ещё не наступило.
В феврале 1914 г. Ван-ден-Брук считал, что внутри атома существуют три “отдельные” области электронов: “периферийные” электроны, включая электроны валентности, “внутренние электроны, дающие, вероятно, характеристическое излучение”, и “свободные ядерные электроны, часть которых может выбрасываться как β-лучи” [9]. По его мнению, количество электронов в каждой из этих областей, а также уменьшение скорости α-частиц при прохождении через вещество и энергия излучения при столкновении β-частиц с электронами зависят от номера элемента Р в его “сжатой” системе (см. табл. 3, которую он впервые привёл в работе [11]).
Примером того, как Ван-ден-Брук использовал свою “сжатую” систему, может служить идея о “внутризарядовых” числах [11].
Ещё раньше [7] он выразил мысль, что если ядро представляет собой сгусток α-частиц, то α-частица, испускаемая из ближайшего окружения такого сгустка, должна проходить области всех других электронов и возбуждать излучение, зависящее от заряда внутри воображаемой сферы, которая в каждый момент движения α-частицы будет для неё некоторым эффективным “ядром”. В таком случае заряд внутри таких сфер должен последовательно увеличиваться (по мере движения α-частицы) от Р (число ядерных электронов) до A/2 (общее число электронов в атоме).
В мае 1914 г. на основе данных Резерфорда и Андраде [111] Ван-ден-Брук пытался показать, что частоты мягких γ-лучей RaB “почти равны квадрату (вероятно, всех) целых чисел от периодического числа Р до половины атомного веса A/2, умноженному на постоянную величину” [11, с. 376]. Аналогичный расчёт был им проведён для β-лучевого спектра RaB. Отсюда Ван-ден-Брук сделал вывод, что атом имеет “скорее планетарное” строение с разными радиусами для всех электронов, чем строение по типу планеты Сатурн, при котором электроны считаются распределёнными в кольцах. Полученные им целые “внутризарядовые числа” для RaB (214Pb) изменялись от Р=60 до A/2=107. “Нет причин, –писал Ван-ден-Брук, – по которым такого рода структура, хотя и не наблюдаемая из-за отсутствия [полных данных для] γ-излучения, не может принадлежать всем элементам. Возможно, что она не совместима с атомной моделью Бора” [11, с. 377].
В 1915 г. в обзорной работе [16] Ван-ден-Брук выдвинул “второе толкование” атомной модели Резерфорда. Перечислив многочисленные попытки найти расположение электронов внутри атома, Ван-ден-Брук отмечает, что “в большинстве случаев” предполагалось существование нескольких колец электронов в одной плоскости. Сам он склоняется к представлениям Дж. Николсона, согласно которым “окружающие ядро электроны могут быть устойчивыми только в кольцах примерно одинакового размера вокруг общей оси во всегда различных параллельных плоскостях”.
Основу построения Ван-ден-Брука составляют симметрично расположенные на общей оси кольца из восьми электронов каждое в соответствии с тем, что периоды в “сжатой” системе содержат восемь элементов. Эти кольца чередуются с одним электроном “на оси или вблизи оси” в соответствии с тем, что в “сжатой” системе есть “лишние” элементы Н, Не, Со, Ni, Rh, Pd, Ir, Pt (см. табл. 3). Редкоземельные элементы, также “лишние”, получаются непрерывным развитием двух колец из восьми электронов и двух электронов, расположенных на оси ближе всего к ядру, в два кольца по 16 электронов каждое (при заряде ядра 72). Начиная с заряда ядра 73, “согласно Бору”, “развитие опять будет обычным”.
В центре такой электронной системы и на той же оси располагается “ядерное кольцо или ядро с чистым положительным зарядом, соответствующим порядковому номеру”. По обеим сторонам “ядерного кольца” в центрах колец из восьми электронов располагаются “нейтральные гелиевые частицы”, которые не вносят вклада в общий заряд ядра. При таком строении ядра прирост атомного веса сверх величины, соответствующей удвоенному порядковому номеру, происходит скачками и именно в тех периодически чередующихся местах, где “присоединяются два новых кольца из восьми электронов”.
В этой же работе [16] Ван-ден-Брук подтвердил ранее выведенное соотношение [13], довольно хорошо связывавшее постоянные распада λ соответствующих членов трёх радиоактивных семейств с их порядковыми номерами М менделеевской системы:
ln[λTh2(λRa·λAc)]= (M–82)3/2.
Опираясь на интерпретацию этого соотношения Ф. Линдеманном [94], Ван-ден-Брук предложил считать ответственными за радиоактивный распад “нейтральные гелиевые частицы” ядра. При столкновении таких частиц из атома вылетает α-частица, а бывшие связанными с нею два электрона занимают место, “вероятно, в непосредственной близости от ядра”: либо вылетают из ядра как β-частицы, либо объединяются с α-частицами ядра. Так Ван-ден-Брук представлял себе ядерный атом в 1915 г.
В августе 1916 г. [19] Ван-ден-Брук выдвинул предположение: “протокислород может быть составной частью атомов”. Основанием для такого предположения послужило то, что “для любых шести порядковых номеров начиная с магния ссредняя разность между атомными весами есть точно 16”. Эта разность соответствует испусканию четырёх α-частиц и двух β-частиц. Поэтому, по его мнению, радиоактивность может быть объяснена образованием внутри ядра и последующим распадом α4β2=θ-частиц, структурно очень похожих на Н4+β2=α-частицу.
Ни одна из перечисленных идей Ван-ден-Брука в целом не была принята в науке. Например, представление о внутризарядовых числах оказалось неправильным при более точном измерении γ-спектров RaB и других радиоэлементов. Также сразу было ясно, что утверждение о “точной” кратности числу 16 “средней” разности атомных весов элементов, разделённых шестью порядковыми номерами, соблюдается очень приближённо. Идеи о “нейтральных гелиевых частицах” в ядре или картина строения атома и ядра по Ван-ден-Бруку не могли быть сразу проверены. Однако можно выделить несколько частных идей, которые были впервые им выдвинуты и так или иначе развивались в дальнейшем.
Ван-ден-Брук, по-видимому, первым заговорил о нейтральных частицах в ядре, правда “гелиевых”, и в связи с ними – о “чисто положительном заряде” ядра. Связь этой идеи с выдвинутыми в 1920 г. У. Харкинсом и Э. Резерфордом гипотезами о нейтроне не установлена. Тем не менее Л. Мейтнер в 1921 г. [97] прямо ссылается на Ван-ден-Брука как автора предположения о α4β2=θ-частицах и использует его представления о нейтральных гелиевых частицах в ядрах. В 1921 г. Резерфорд и Чадвик [115] выдвигают предположение о Н+-ядрах как “спутниках” (сателлитах) центральных ядер, что созвучно со схожим представлением Ван-ден-Брука в отношении нейтральных гелиевых частиц вне центрального ядра. Ван-ден-Брук выполнял очень нужную науке теоретическую обработку экспериментальных данных: пользуясь оригинальным методом представления результата, выдвигал новые идеи, которые удовлетворяли бы всем этим данным.
Дата установки: 28.07.2010
[вернуться к содержанию сайта]