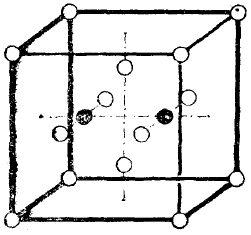
Рис. 1.
[вернуться к содержанию сайта]
В основу теории легли представления о "кубическах" атомах Lewis'а1) и о насыщенных и ненасыщенных атомных кольцах Kossel'я 2). Сопоставляя результаты этих работ с формулой Rydberg'а 3), выражающей атомный номер благородных газов в виде ряда: N=2(1+22+22+32+32+42+…), автор приходит к заключению, что целый ряд физических и химических свойств элементов и соединений можно объяснить, если принять следующие постулаты.
1) Электроны в атомах благородные газов располагаются в парных плоскостях, симметричных относительно ядра. Атомы имеют ось симметрии, перпендикулярную к этим плоскостям.
2) Электроны находятся внутри ряда концентрических шаровых слоёв одинаковой толщины, радиусы которых относятся как 1:2:3:4: … , а поверхности, как 12:22:32:42: …
3) Каждый сферический слой распадется на несколько ячеек равного объёма. Первый слой (в сущности шар), содержит две ячейки, отделённые друг от друга экваториальной плоскостью. Второй слой распадается на 8 ячеек, третий на 18 и т. д.
4) Каждая из двух внутренних ячеек может содержать только по одному электрону, все же остальные – по два или по одному.
5) Электроны воздействуют друг на друга электростатическими и электромагнитными силами, уравновешивающимися взаимно.
6) В случае превышения предельного устойчивого количества электронов во внешнем слое – начинают преобладать электростатические силы и изливший электрон отталкивается в следующий слой.
7) Свойства атома обусловлены числом электронов во внешнем слое.
8) Наиболее устойчивыми и симметричными являются расположения электронов в благородных газах, характеризующихся максимальными внутренними силами, при минимальных внутренних полях.
9) Наиболее устойчивой системой является атом гелия.
10) Очень устойчивой является система, состоящая из одного ядра и восьми электронов, располагающихся вокруг него ("octet").
11) У двух "octet'ов" могут быть взаимно связаны одна, две, три или более пар электронов. Точно также связь может оказаться и между "октетом" и устойчивой системой, построенной наподобие атома гелия.
Ни один из электронов не может участвовать более чем в двух "октетах". Электроны могут переходить из одного "октета" в другой.
Расположение электронов в "октете" может быть двух родов: или по одному в вершинах куба (с положительным ядром в центре), ила – по два (связанных электромагнитными силами) в вершинах правильного тетраэдра.
В атомах всех элементов, кроме инертных газов, внешние электроны не образуют полных "октетов", а потому они вступают в химические соединения между собой, причём электроны из одного атома переходят в другой для образования полного "октета".
Теория Langmuir'а, к сожалению, пока лишена математической обработки и не объясняет, почему электроны остаются на своих местах в состоянии покоя (впрочем, автор ссылается на работу J. J. Thomson'а, исследовавшего равновесие атомных систем с точки зрения "силовых трубок"), но схемы, предложенные Langmuir'ом, очень наглядно иллюстрируют целый ряд химических и физических процессов: образование сложных соединений, плавление, кипение, электропроводность.
В качестве примера приведём модели а) молекулы воды и b) молекулы азота.
a) У воды чёрный кружок на рис. 1 обозначает ядро кислородного атома, чёрные крестики – ядра водородных атомов, а белые кружки – электроны. Электростатические силы сместили четыре электрона из вершины куба, где они находились в молекуле кислорода.

Рис. 1.
b) Целый ряд свойств азота сближает его с благородными газами, поэтому модель молекулы азота, по теории автора, должна иметь вид, представленный на рис. 2, где чёрными кружками обозначены ядра атомов азота, соединившихся в молекулу, и белыми кружками – электроны.
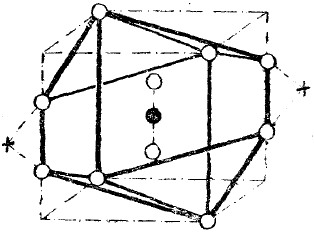
Рис. 2.
Дата установки: 21.09.2012
[вернуться к содержанию сайта]